Nat Commun | 华师大叶海峰团队研发人造抗病毒免疫样系统
| 导读 | 2022年12月9日,Nature Communications刊登了华东师范大学叶海峰研究员团队和杜克-新加坡国立大学医学院王林发院士团队,历时8年在抗病毒免疫领域的最新研究成果“Engineering antiviral immune-like systems for autonomous virus detection and inhibition in mice” |

为了更加形象地展示ALICE系统的作用原理,研究团队用“后羿射日”的典故比拟该系统,后羿是装载ALICE基因线路的底盘细胞,手上的弓箭是不同类别的抗病毒功能蛋白,天上的太阳代表不同种类的病毒。后羿精准操控弓箭,击碎病毒(研究团队供图)
随着全球气候变暖,未来全球将面临更多新发或再发病毒引发的传染病疫情。此前的埃博拉病毒、甲型H1N1流感、寨卡病毒、以及最近的新冠病毒肺炎(COVID-19)疫情,都对全球的经济、公共卫生安全、以及人类健康,产生了巨大冲击。除此类突发病毒外,长期潜伏于机体的病毒,如人类免疫缺陷病毒(HIV)、乙型肝炎病毒(HBV)、人乳头瘤病毒(HPV)以及单纯疱疹病毒1型(HSV-1)等,也因其高传染性和反复发作的特点,较难防治。因此,迫切需要建立针对病毒感染的广谱性抗病毒新策略。
但是现有的病毒检测和清除策略均分开独立进行,尚未有集病毒检测和清除为一体的工程化系统。这促使研究者设计开发针对病毒的闭环式基因线路,实现体内病毒检测清除一体化、自动化和智能化。
2022年12月9日,Nature Communications刊登了华东师范大学叶海峰研究员团队和杜克-新加坡国立大学医学院王林发院士团队,历时8年在抗病毒免疫领域的最新研究成果“Engineering antiviral immune-like systems for autonomous virus detection and inhibition in mice”。研究团队设计了一组集病毒检测清除于一体的闭环式人造免疫样系统ALICE。该系统成功模拟了人体的抗病毒免疫系统,能够自动感应和破坏入侵的病毒。该系统以感知外源核酸的STING蛋白为接头,连接人工搭建的信号反应网络,同步输出多重抗病毒功能模块(包含抗病毒细胞因子IFN-α和IFN-β、降解病毒核酸的CRISPR-Cas9、抗病毒中和抗体)。当病毒入侵时,ALICE系统能够自动感知,并同步输出抗病毒功能蛋白,发挥抗病毒效果。

结果
01 ALICEsen系统和ALICEim系统
首先,研究者设计了ALICEsen系统(图1a),该系统中STING接头蛋白(stimulator of interferon gene)在细胞中表达,以感知外源核酸,从而激活STING-TBK1-IRF3信号通路,同步输出多重抗病毒功能模块(包含抗病毒细胞因子IFN-α和IFN-β、降解病毒核酸的CRISPR-Cas9、抗病毒中和抗体)。研究者通过对ALICEsen系统的优化,实现了对STING-依赖的多种病毒的广谱性响应(图1b),包括:2型登革病毒(DENV-2)、SARS-CoV- 2、hCoV-229E、肝炎病毒(HCV)、乙型肝炎(HBV)、腺病毒(ADV)和1型单纯疱疹病毒(HSV-1)。随后的研究发现,ALICEsen系统表现出病毒感染时间和剂量依赖性(图1c-e),同时,该系统在不同细胞系中具有普适性(图1f)。
I型干扰素(IFN-α/β)参与激活先天免疫信号通路,具有广谱抗病毒活性。基于此,研究团队设计了病毒诱导的免疫样感应和清除的ALICEim系统,在该系统中,作者将输出模块设计成IFN-α和IFN-β。通过结果显示,在病毒(HCV、HBV、ADV、HSV-1)存在时,ALICEim系统启动IFN-α和IFN-β的表达,进而抑制病毒感染(图1g-o)。这表明ALICEim系统可作为一种人工先天免疫系统,通过诱导干扰素表达释放发挥固有免疫系统抗病毒功能。
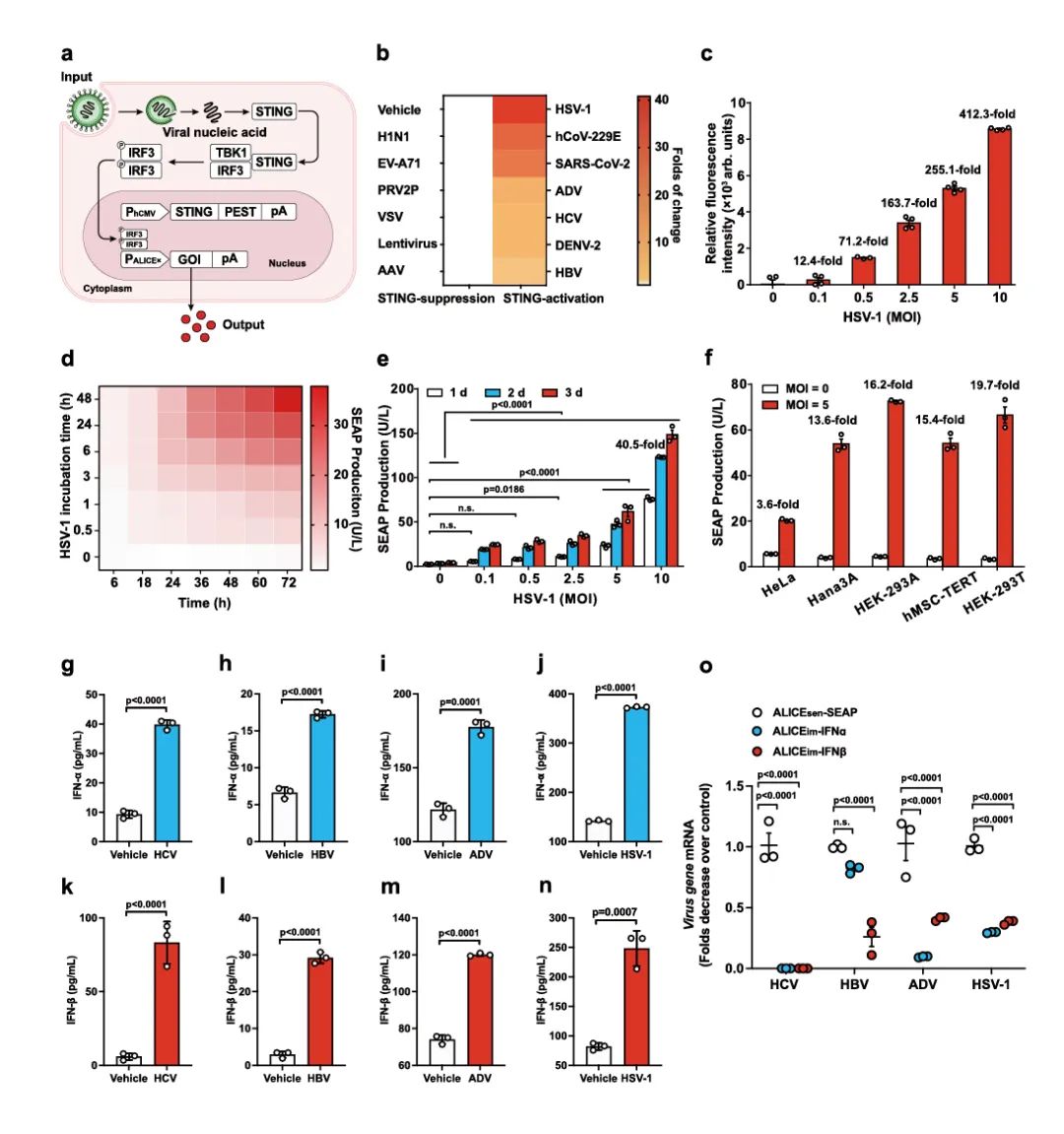
图1 ALICEsen系统设计和验证
02 ALICECas9系统
进一步,研究团队又开发了自动感应和降解病毒基因组的ALICECas9系统(图2a),该系统仅在检测到病毒基因组时诱导Cas9表达,避免了Cas9蛋白长期存在引起的细胞资源消耗、脱靶、出现Cas9耐药突变病毒等副作用。此外研究者还针对不同病毒设计多个sgRNA,实现了对ADV和HSV-1的同时清除(图2g)。

图2 ALICECas9系统设计和验证
03 ALICECas9+Ab系统
随后,研究团队还设计开发了自动感应和阻断病毒的ALICEAb系统,通过诱导中和抗体发挥适应性免疫防御,达到清除病毒的目的。
基于ALICECas9系统和ALICEAb系统,研究团队继续设计开发了更强大的自动感应和抑制病毒的ALICECas9+Ab系统(图3a),协同发挥出更强的抗病毒效果(图3b)。研究结果显示,在HSV-1存在的情况下,Cas9和E317Ab(HSV-1中和抗体)可在一周内持续表达(图3c),体现了ALICECas9+Ab系统的长期抗病毒作用。此外,ALICECas9+Ab系统还表现出与高剂量ACV(阿昔洛韦,抗HSV-1药物)类似的抗病毒效果(图3c),这有效避免了长期使用ACV引起的病毒耐药性。通过Transwell实验发现,ALICECas9+Ab系统可以显著抑制HSV-1在宿主细胞中的传播,同时具有一定的自我保护能力(图3d-g)。
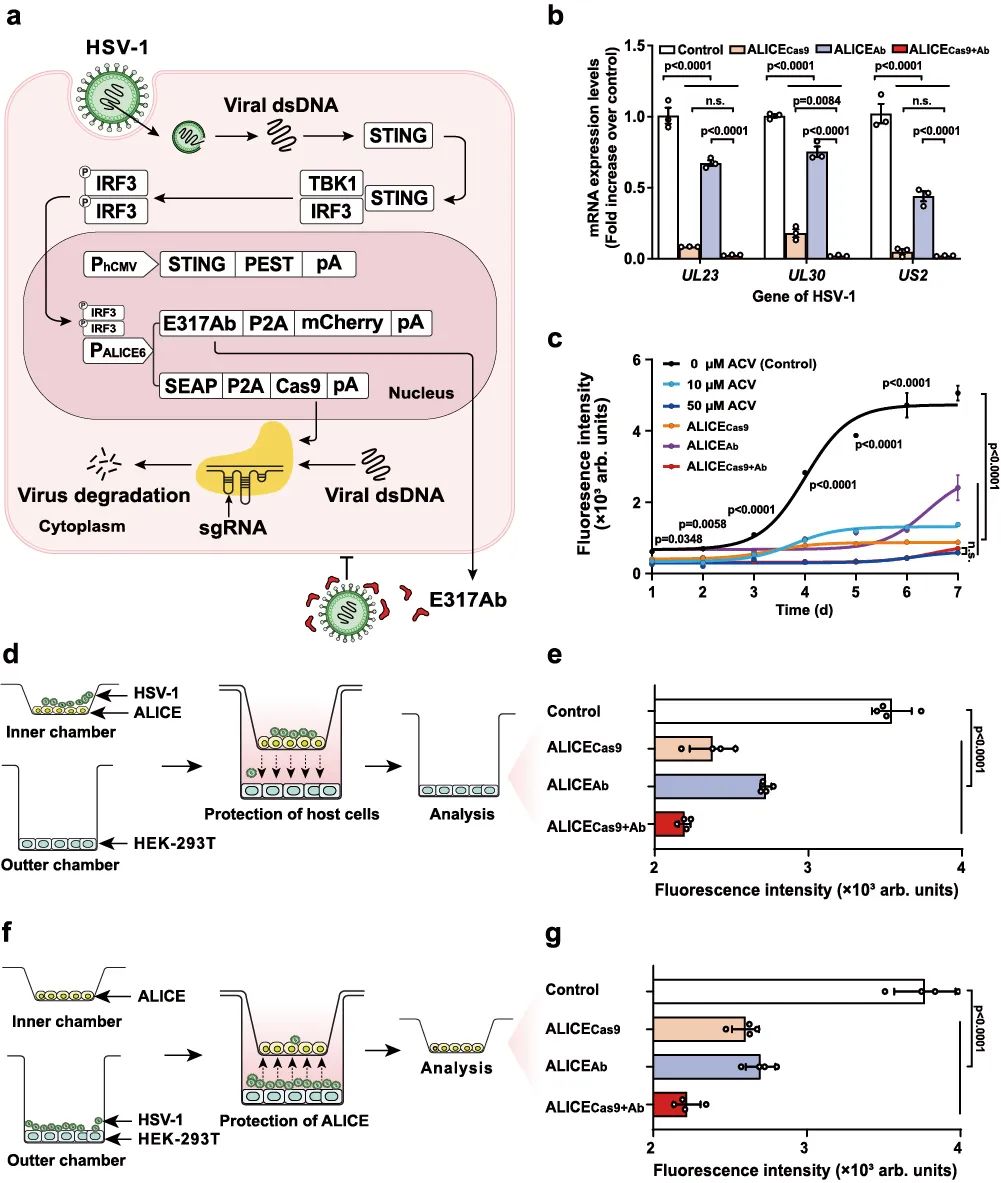
图3 ALICECas9+Ab系统的设计与验证
04 ALICE系统体内验证
基于上述一系列ALICE系统的设计与体外结果,研究团队继续验证该系统在体内的可行性。研究者将含有ALICE系统的细胞,通过水凝胶包裹形式腹腔注射移植到小鼠体内,并检测病毒感染前(HSV-1感染小鼠20h后,进行ALICE系统移植)、中(ALICE系统移植20h后,进行HSV-1感染小鼠)、后(ALICE系统移植28天后,进行HSV-1感染小鼠)期,ALICE系统抗病毒效果。结果显示,无论在病毒感染前、中、后期,ALICE系统均表现出良好的自动感应、预防病毒感染/抑制病毒感染的能力,其中ALICECas9+Ab系统在长达6天内展现出更优的抗病毒效果,具体表现为:当检测到病毒侵入时,移植ALICECas9+Ab系统的小鼠E317Ab表达显著升高,且与对照组相比,移植ALICECas9+Ab系统的小鼠Cas9的表达也明显升高,病毒RNA水平显著降低,HSV-1感染引起的炎症因子(IL-6、CCL5、CXCL10、TNF-α和IFN-α)的表达也显著降低。
最后,为进一步探索ALICE系统的临床应用前景,研究团队选取由HSV-1感染引发的疱疹性角膜炎(HSK)小鼠模型,借助rAAV载体眶后注射(retro-orbital, RO)递送ALICE系统至小鼠的眼角膜(图4a)。结果显示,ALICE系统能够成功抑制小鼠角膜、三叉神经节以及大脑中的病毒载量,降低HSV-1感染引起的炎症反应,显著减轻HSK模型小鼠的表征;并且面对病毒的迭代感染,也能发挥良好的抗病毒效果(图4b-o)。
目前,临床上治疗HSV-1的常用方法是抗病毒药物,如阿昔洛韦(ACV)等核苷类似物,这类药物靶点单一,极易造成耐药毒株的出现。ALICE系统的出现无疑是给抗病毒治疗领域,提供了一种灵活、创新、模块化的抗病毒治疗新策略。
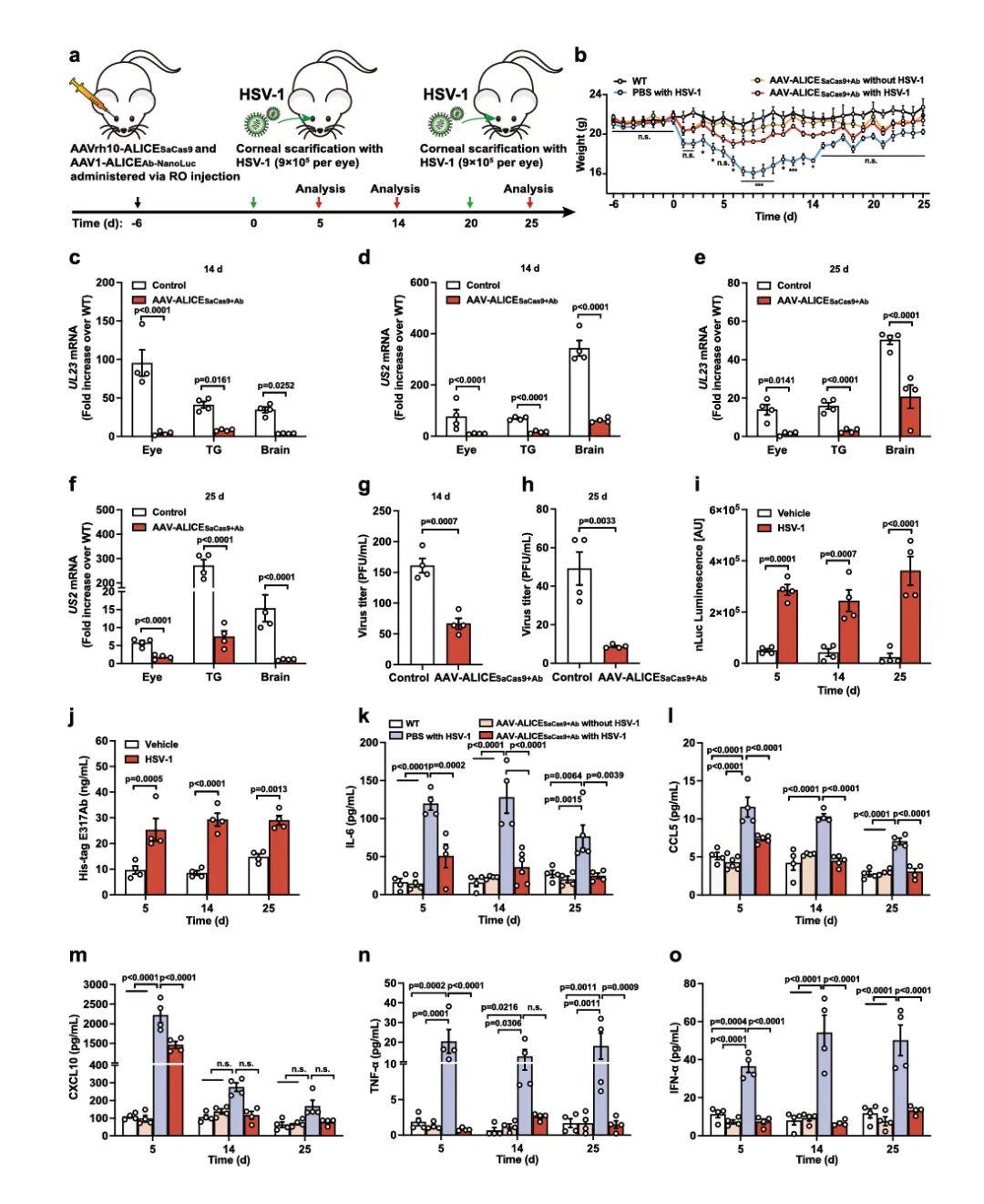
图4 rAAV载体介导的ALICE系统在HSK小鼠模型中发挥抗病毒作用
结论![]()
总而言之,模块化设计的闭环式ALICE系统,拥有可更换的检测模块、灵活布线的内源信号网络、多重的输出模块,经由不同的底盘细胞或AAV载体递送,能够灵活应用于特定的病原体防控需求。
ALICE技术平台作为人造抗病毒免疫系统,可诱导干扰素表达释放发挥非特异性抗病毒免疫功能,或诱导中和抗体等发挥适应性免疫防御,增强机体的免疫防御体系。研究团队认为,本研究中的各类ALICE系统可作为示例模型,未来很容易适应特定免疫样细胞的设计开发,实现以哺乳动物为目标的潜在病原体的智能感应和清除。
华东师范大学叶海峰研究员和杜克-新加坡国立大学医学院王林发院士为该研究论文的共同通讯作者,华东师范大学博士后王义丹为该研究论文的第一作者。
该工作得到南京大学李尔广教授、同济大学王平教授、中科院武汉病毒研究所周鹏研究员及其团队、中科院武汉病毒研究所裴荣娟副研究员及其团队以及杜克-新加坡国立大学医学院王林发教授及其团队的大力支持。
该研究工作获得了国家自然科学基金委国际合作项目的资助。
和元生物有幸为研究者提供实验中使用的AAV、慢病毒、腺病毒,助力神经科学研究!
https://www.nature.com/articles/s41467-022-35425-9
业务咨询
更多活动详情可长按或扫描下方二维码,填写表单,我们将尽快安排专人与您联系!


和元生物(股票代码:688238)致力为神经科学研究和药物开发提供从神经系统标记、环路示踪、基因操作、生理操作到观察验证的全面灵活服务,可以提供从病毒包装(腺相关病毒/慢病毒/腺病毒/逆转录病毒)、细胞功能实验、动物实验研究到病理研究的一站式服务。聚焦基因治疗载体,用实际行动助力中国脑科学和神经系统疾病基因治疗的发展!

长按扫码关注我们
赋能基因治疗
共守生命健康
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发