本文为 Abcam 的完整药物发现和开发解决方案,欢迎全文阅读,助力您的药物开发项目!Abcam 保证长期供应,强调优质、经过验证的生物试剂和工具的重要作用。
全文概览
.简介
.重组单克隆抗体 - 可批量生产,确保长期供应,具备批间一致性,提供可重复性结果
.重组抗体对 – 支持获得可靠的ELISA 结果,并可扩大检测规模
.直标一抗 – 高一致性,减少自行偶联试错成本
.高通量多重免疫检测 - 收集更多有意义的数据,加快下一次发现进程
.经验证满足严格标准的优质重组蛋白- 确保检测和细胞培养的长期性能一致
.CRISPR 基因敲除细胞系和定制服务 - 有效建立经优化的疾病模型,更加准确地预测药物安全性和疗效
.结论
.参考文献
01 简介
生物制药公司将继续通过新药开发和上市来应对生产力挑战,这些挑战包括需要更快推进药物研发过程等方面日益增加的压力 1,2。虽然近来药物开发过程有所延长,开发成本也有所上涨 3-5(图 1),但新药的批准率一直保持稳定。
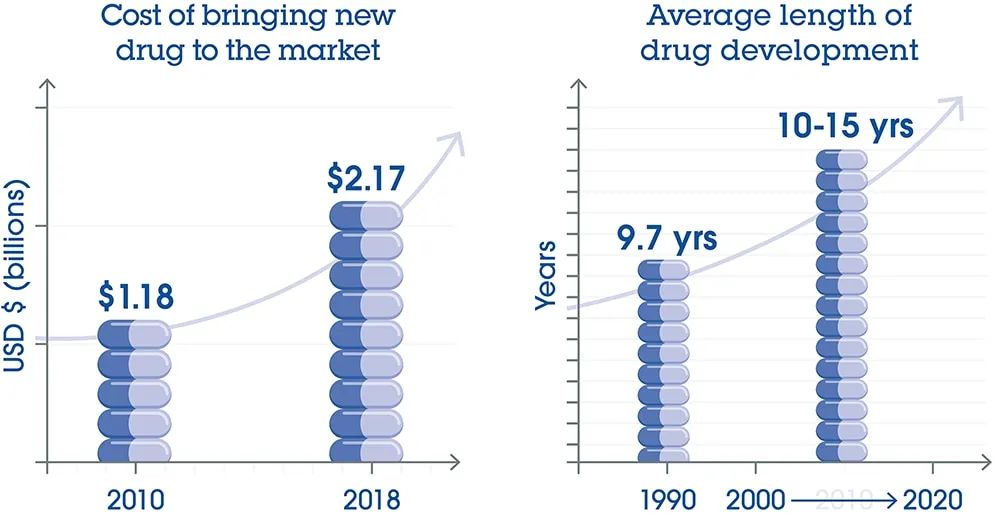
图 1. 相较 2010 年的 11.8 亿美元, 2018 年的新药上市成本为 21.7 亿美元,增幅近 100% 3。除成本变高外,药物开发过程也变长。在过去二十年中,药物开发平均耗时 10-15 年,而 1990 年代则为 9.7 年 4,5。
导致开发时间变长和成本增加的因素有更加严格的监管要求、招募临床试验患者的困难以及行业研究重心转向高风险高回报领域(如肿瘤学)5。另一个主要因素是可避免的实验支出(AEE),即“设计和实施临床前实验过程中所有的效率低下和生产力挑战问题”6。
临床前研发支出占药物开发总支出的 42.9%,主要花费在使用关键生物试剂开展的实验上。令人震惊的是,临床前实验的不可重复率超过 50%,业内每年在此方面支出近 480 亿美元 7。虽然导致 AEE 的因素有很多,但不适当或有缺陷的试剂是最重要的因素之一,超 170 亿美元的支出可归入劣质生物制品和参比材料支出。这也是超 36% 的临床前研发实验无效的原因 6,7。
减少与生物试剂相关的 AEE 可帮助药企节省约 170 亿美元的不必要支出,并简化工作流程,提高研发效率。此外,候选药物还可以更快进入临床试验,从而加快开发产品线的进程。
与药物开发的临床阶段不同,生物试剂的开发和使用标准不受任何监管机构(如美国食品药品管理局或欧洲药品管理局)的监管。因此,常用生物试剂(包括抗体、重组蛋白、细胞系和相关模型系统)的性能会有不一致性,具体取决于制备这些试剂的生物系统 8,9。
使用经充分验证的市售生物试剂可节省宝贵的时间和成本,从而提高整个工作流程中药物发现和开发应用的效率。本文讨论了一系列具备批间一致性的优质产品,这些产品有助于实现实验结果的可重复性、简化工作流程、加快项目进展和减少资源浪费,从而克服效率低下的挑战。
02 重组单克隆抗体 - 可批量生产,确保长期供应,具备批间一致性,保障可重复性结果
使用劣质抗体开展临床前研究或生物标志物检测会导致研究结论不可靠,从而增加后期临床试验的成本 9。要想在整个冗长的药物开发过程中得到可重复性结果,科学家需使用在研究中始终表现性能良好的特异性抗体。
单克隆抗体是发现和开发有效药物或生物标志物的宝贵工具,可用于定量、定位和调控目标蛋白。然而,使用传统杂交瘤技术制备的单克隆抗体可能在特异性和可重复性方面出现问题。特异性问题源于杂交瘤细胞系表达额外的高产重链或轻链,导致抗体呈现非特异性。此外,随着时间的推移,杂交瘤细胞系还可能出现基因丢失、突变和遗传漂变,从而导致制备的抗体性能发生改变。
使用重组单克隆抗体将有助于克服杂交瘤技术来源的单克隆抗体存在的特异性和可重复性问题 10。将抗体基因克隆到高产率表达载体中,在体外进行重组生产,再将其导入表达宿主产生重组抗体。由于重组抗体的基因序列已知,因此可在基因水平使用抗体工程技术进一步开发重组抗体,从而增强抗体性能,例如提高亲和力、减少背景或非特异性信号,从而最大限度地提高灵敏度。
与杂交瘤细胞制备抗体不同,抗体的重组表达可控且可靠。因此,重组抗体可轻松地实现批量生产,保持批间一致性,且可确保长期供应。因此,☞Abcam重组抗体非常适用于使用相同抗体开展长期研究或多样本研究,确保获得药物发现和开发研究所需的高可重复性结果。
图 2. 重组抗体特点概要。
抗体领域权威专家(包括 Specifica 首席战略官、抗体学会创始主席 AndrewBradbury)极力倡导在研究中使用重组抗体,以提高可重复性:“如果所有抗体均由其序列定义并以重组方式制备,全球研究人员将能够在相同条件下使用相同的结合试剂 11。”
对于所有抗体,无论采用哪种生产方法,每一批抗体的特异性和选择性都要经过广泛验证(包括特定的应用验证),从而确保抗体达到最高质量。基因敲除(KO)验证是接受度最广且最受信任的抗体特异性验证方法之一。这种方法十分严格,需要使用不表达靶蛋白的 CRISPR 基因敲除( KO)细胞系和野生型细胞系对每批抗体进行验证。
03 重组抗体对 – 支持获得可靠的ELISA 结果,并可扩大检测规模
确保高特异性重组单克隆抗体的持续供应对于开发稳健可靠的assay用于使用多样本的长期药物开发研究至关重要。开发夹心法 ELISA时需仔细选择抗体对,即未标记的捕获抗体和带有偶联标记的检测抗体(两种抗体均能与靶蛋白特异性结合),并还需要用于样本蛋白定量的、经校准的重组蛋白标准品。
使用优化过的重组单克隆抗体对(图 3)可以规避研究人员使用单克隆(杂交瘤)或多克隆抗体时遇到的可重复性和批量生产问题,这些问题会导致实验结果产生差异。筛选和优化抗体对配对是至关重要的验证工作。按灵敏度对抗体对进行筛选,并在血浆、血清、细胞裂解液等多种复杂样本类型中对抗体对进行严格测试。使用☞Abcam重组抗体对可以轻松将您的检测方法从小型试点研究高效扩展到高通量检测平台,从而实现具有成本效益的药物发现。

04 直标一抗 - 高一致性,减少自行偶联试错成本
随着研究和检测方法复杂性的增加,在诸如 IHC、流式等实验应用中引入直标一抗可减少孵育步骤和液体处理,从而节省手动操作时间,简化工作流程。此外,与二抗相比,引入直标一抗不仅可以减少非特异性结合,还可以最大限度地降低种属交叉反应性。
然而,寻找抗体和感兴趣的标记物组合仍然是使用直标抗体的关键挑战。如果市场上没有合适的直标抗体,使用实验操作快速、简单的抗体偶联试剂盒是一种直截了当的解决方案。选择批间一致性高的偶联试剂盒至关重要,因为可实现在多种偶联规模下产生可重复性的结果。
一个经常被忽视的问题是,使用 BSA 或其他添加剂(例如甘油或叠氮化钠)制备的一抗或抗体对可能会干扰偶联反应。而对于依赖细胞培养的功能性检测,抗体配方不应包含对细胞有毒性的叠氮化物。因此,为了进行高效的抗体偶联和细胞功能性检测,应在无叠氮化物和无载体蛋白(不含 BSA)的缓冲液中制备抗体和抗体对。
Abcam提供超过5900个☞直标一抗,减少自行偶联的烦恼,而Abcam 覆盖标记物种类齐全的☞Lightning Link偶联试剂盒具有快速、高回收率、高标记效率的特点,搭配超过13000个☞无载体形式的抗体,使您可使用的直标一抗更加多样。另外,Abcam还提供专业的☞抗体偶联定制服务,可以最大限度地帮助您减少偶联过程中的试错次数,从而节省宝贵的资源和时间。
05 高通量多重免疫检测 - 收集更多有意义的数据,加快下一次发现进程
高通量筛选(HTS)是早期药物发现期间常用的重要方法,旨在从庞大的化合物文库中筛选并找到可调控靶点活性的化合物。成功的高通量筛选需使用可规模扩大的、高质量的免疫检测方法,来快速、高效、低成本地来鉴定最有前景的化合物12。
传统的单一分析物免疫检测方法,如 ELISA,在早期药物发现和临床试验中评估药物治疗反应方面仍极具价值。但当需要高通量检测多个靶蛋白时,单一分析物免疫检测方法在成本、劳动力、耗时和所需样本量方面效率低下。☞多重免疫检测方法可以克服这些问题,其在单孔中使用最少的样本量可检测多个靶点,使得在高通量筛选时获得指数级增加的数据点。通过同时检测多个分析物,多重免疫检测可以让研究者在单次检测实验中获取更多洞见,☞加快和扩展生物标志物分析,同时减少研究者的工作量。
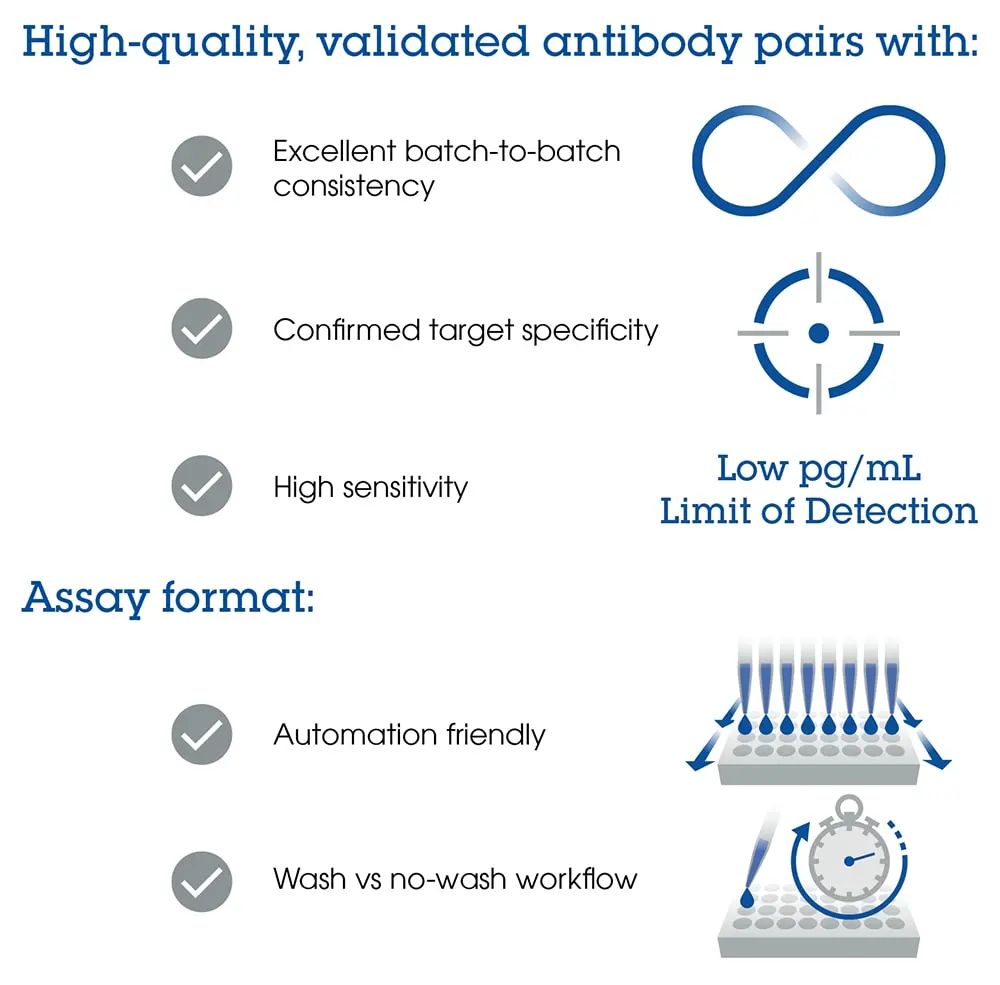
☞高通量多重免疫检测融合了多重分析和高通量分析功能,因此可收集更多有意义的数据,从而在不影响检测方法性能或数据质量的情况下,改进药物发现早期阶段的决策。☞选择合适的多重检测方法时,需要考虑多项因素,如检测特异性、灵敏度和可重复性(均依赖于优质的抗体对)、自动化兼容性和免清洗,以及免洗涤vs 洗涤的形式(图 4)。自动化可减少潜在的操作失误,同时促进检测规模放大的过程。免洗涤检测工作流程可减少试剂处理和最终数据采集之间的步骤,增加通量。
图 4.选择用于药物发现的多重检测方法时需要考虑的主要因素。要了解更多信息,请下载☞药物发现多重分析综合指南。
06 经验证满足严格标准的优质重组蛋白 – 确保检测和细胞培养的长期性能一致
由于蛋白是大多数上市药物的靶点,因此体外和体外检测方法开发、化合物筛选和结构研究需要使用优质的纯化重组蛋白。由于蛋白质量问题会影响其预期实验应用的可靠性,因此需对重组蛋白进行严格的质量控制。细胞培养是基础研究、转化研究和临床应用必须的实验技术,其需要生物活性蛋白(例如细胞因子和生长因子)。由于蛋白的质量会显著影响培养细胞的特性和功能,因此必须按照最高标准生产这些生物活性蛋白,以确保结果的可靠性和可重复性 13。
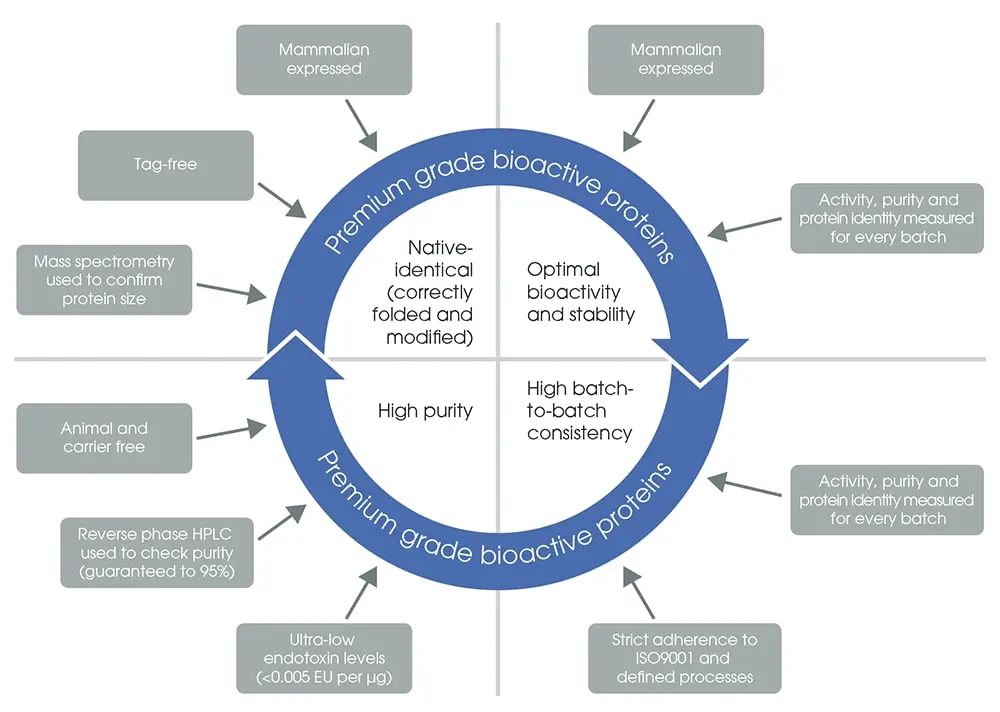
为了获得最佳的生物活性,重组生物活性蛋白在☞哺乳动物系统中表达,以正确地折叠和进行翻译后修饰(图 5)。每个新批次的生物活性蛋白均须通过严格的质量控制检测,以确保一致的完整性、纯度、浓度且正确折叠,此外,还须在明确定义的特定产品体外功能性检测中确认其生物活性。每个新批次蛋白必须做对照主批次的数据验证,以控制检测方法应用的不一致性。Abcam推出了按高标准生产的超过92种☞特优级生物活性蛋白,其优势见下图:
图 5. Abcam ☞特优级生物活性蛋白的主要性能。
07 CRISPR 基因敲除细胞系和定制服务 - 有效建立经优化的疾病模型,更加准确地预测药物安全性和疗效
约 95% 进入临床试验的药物以失败告终,而药物开发在临床试验阶段失败的主要原因之一是药物对预期的疾病适应症缺乏疗效 14。药物缺乏疗效是因为in vitro和in vivo临床前人类疾病模型的有效性和预测性差所导致的临床前研究中的药物错误发现率偏高。许多当前使用的临床前检测方法均不适用于解决安全性问题和评估off-target效应。
CRISPR 基因敲除技术给细胞工程带来了准确性和速度,促进了复杂疾病相关的细胞检测方法的发展,进而提高了药物疗法的可预测性 15-19。目前,CRISPR技术已被应用于各个临床前阶段,用以加快工作流程,加速和验证研发管线中的治疗资产,减少后期消耗,最终减少开发成本。
与其它技术相比(例如 RNAi),CRISPR 技术可以更完全地敲除靶基因,避免产生不必要的效应,让大型基因功能实验的数据结果更加可靠。同样地,☞CRISPR KO 细胞系是验证抗体特异性的最有价值的工具之一。
虽然 CRISPR 技术为药物发现和开发工作带来了新的希望和可能性,但稳转 ☞CRISPR 细胞系或模型的基因工程会是复杂且耗时的。与其花费数月自行构建 CRISPR 基因敲除细胞系(图 6),购买商业化的KO细胞系,或者与具备成熟的Gene editing技术平台并可提供☞Gene editing 细胞定制服务的公司合作,以此消除项目中的技术和时间限制。
图 6. 市售基因敲除细胞系定制服务与Abcam 目录基因敲除细胞系货期耗时对比。
08 结论
在药物发现过程中的早期阶段与声誉良好的、提供经验证的优质生物试剂的供应商合作,为克服效率低下的挑战和节省宝贵的时间和资源提供了可行的解决方案。由于药物开发是一个漫长的过程,因此许多研究长期需要批间一致性良好且经广泛验证的生物试剂。本文论述了多种产品解决方案,这些解决方案可以确保研究人员在整个药物开发产品线中获得可重复性结果,同时简化流程,加快进程并减少资源浪费。
首先,重组生产的抗体和蛋白本质上适用于控制蛋白表达和生产出批间高一致性的产品。重组生产便于扩大规模生产,可以确保所需蛋白或抗体的长期供应,并在您整个药物开发过程中提供可重复性结果。
其次,使用自动化多重检测方法代替单一检测方法,或者使用偶联一抗替代二抗,可以减少过程步骤和液体处理次数,从而简化工作流程,减少资源浪费。最后,经过专业化设计的 CRISPR 基因敲除细胞系有助于构建更完美的疾病模型,从而更加准确地预测药物安全性和疗效,同时加快临床前药物的开发速度。
如您想要下载 Abcam 药物发现和开发分阶段的详细解决方案(如以下内容),您可以扫描下方二维码
1《Abcam 药物和诊断试剂开发产品技术概览及经典客户合作案例》
2《药物靶点发现和验证解决方案》
3《抗体药的筛选与鉴定解决方案》
4《先导药物优化解决方案》
5《临床前开发和质控解决方案》
参考文献
1. Paul, S., Mytelka, D., Dunwiddie, C. et al. How to improve R&D productivity: the pharmaceutical industry’s grand challenge. Nat Rev Drug Discov 9, 203–214 (2010).
2. Pammolli, F., Magazzini, L. & Riccaboni, M. The productivity crisis in pharmaceutical R&D. Nat Rev Drug Discov 10, 428–438 (2011).
3. Terry, C., Lesser, N. Ten years on, Measuring the return from pharmaceutical innovation 2019. Deloitte. https://www2.deloitte.com/content/dam/Deloitte/uk/Documents/life-sciences-health-care/deloitte-uk-ten-years-on-measuring-return-on-pharma-innovation-report-2019.pdf. Accessed September 2021. (2019).
4. DiMasi, Joseph A., Henry G. Grabowski, and Ronald W. Hansen. Innovation in the Pharmaceutical Industry: New Estimates of R&D Costs. Journal of Health Economics. North-Holland, February 12, (2016).
5. Norman, Gail A. Van. Drugs, Devices, and the FDA: Part 1: An Overview of Approval Processes for Drugs. JACC: Basic to Translational Science. Elsevier, April 25, (2016).
6. BenchSci: Avoidable Experiment Expenditure (AEE) Whitepaper. https://landing.benchsci.com/avoidable-experiment-expenditure#form. Accessed August 2021. (2020).
7. Freedman LP, Cockburn IM, Simcoe TS. The Economics of Reproducibility in Preclinical Research [published correction appears in PLoS Biol. 2018 Apr 10;16(4):e1002626]. PLoS Biol. 13(6):e1002165. (2015).
8. Depalmo, A. Authenticating biological reagents. Lab Manager. https://www.labmanager.com/business-management/authenticating-biological-reagents-2435. Accessed August 2021. (2018).
9. Baker, M. Reproducibility crisis: Blame it on the antibodies. Nature 521, 274–276 (2015).
10. Marx, V. Change-makers bring on recombinant antibodies. Nat Methods 17, 763–766 (2020).
11. Bradbury, A., Plückthun, A. Reproducibility: Standardize antibodies used in research. Nature 518, 27–29 (2015).
12. Eller, C. How to accelerate drug discovery with optimized high-throughput screening. Select Science. https://www.selectscience.net/editorial-articles/how-to-accelerate-drug-discovery-with-optimized-high-throughput-screening/?artID=55256&utm_source=Abcam&utm_medium=referral&utm_campaign=social-sharing-cc1. Accessed September 2021. (2021).
13. Gerhartz, B. Excellent standards drive commercial demand in bioproduction. Laboratory News. https://www.labnews.co.uk/article/2031177/excellent-standards-drive-commercial-demand-in-bioproduction. Accessed October 2021. (2021).
14. Hingorani, A.D., Kuan, V., Finan, C. et al. Improving the odds of drug development success through human genomics: modelling study. Sci Rep 9, 18911 (2019).
15. Corrigan-Curay J. et al. Genome Editing Technologies: Defining a Path to Clinic. Mol Ther. 23(5): 796–806 (2015).
16. Muthuirulan, P. CRISPR: Kick-starting the revolution in drug discovery. Drug Target Review. https://www.drugtargetreview.com/article/53152/crispr-kick-starting-the-revolution-in-drug-discovery/ . Accessed October 2019. (2019).
17. Enzmann, B.L, Wronski, A. How CRISPR is accelerating drug discovery. GENENG News. https://www.genengnews.com/insights/how-crispr-is-accelerating-drug-discovery/. Accessed September 2021. (2019).
18. Carter, C. SelectScience. Speeding the transition from bench to bedside with CRISPR-Cas9. 223 Jul. https://www.selectscience.net/editorial-articles/speeding-the-transition-from-bench-to-bedside-with-crispr+cas9/?artID=52023. Accessed August 2021. (2020).
19. Scott, A. A CRISPR path to drug discovery; Gene editing is quietly revolutionizing the search for new drugs. Nature 555, 10-11 (2018).




 腾讯登录
腾讯登录




还没有人评论,赶快抢个沙发