摘要
免疫检查点疗法耐药性问题的出现,突显了肿瘤的复杂多变性和单靶点治疗的不足,多靶点协同治疗成为更好的策略。VISTA是唯一组成型表达于初始T细胞的免疫抑制分子,作用机制和作用阶段皆不同于PD-1/PD-L1、CTLA-4,在多种肿瘤模型中靶向抑制VISTA和PD-1协同治疗结果令人惊喜,而VISTA激动剂在自体免疫病模型中亦表现出诱人前景,这些表明围绕着VISTA靶点或调控其活性是一个具有一定潜力的药物开发方向。
近期,Abcam 公布VISTA EPR21050克隆和Claudin18.2 EPR19202组化加强验证报告,为药企/诊断公司开发相应的(伴随)诊断/检测试剂提供了重要参考,VISTA EPR21050克隆加强验证报告涵盖肺癌、结肠癌、肝癌、子宫内膜癌共超过350例样本,并提供Leica BondRx优化实验参数、代表性染色图片、H-Score分析结果。
欢迎扫码下载报告,
或向Abcam反馈您需要的
其它肿瘤免疫靶点组化抗体的加强验证数据。
免疫检查点是指一类由免疫细胞产生、负责调控免疫应答持续性与免疫耐受的信号通路分子,通过刺激性或抑制性调控免疫细胞活化,在自身免疫病以及癌症免疫监控中发挥作用。免疫检查点抑制剂能够阻断肿瘤引发的免疫抑制(逃逸),靶向PD-1/PD-L1,CTLA-4的抗体在已在几种类型的癌症阻断免疫治疗中获得了激动人心的临床成功。但是这类免疫检查点阻断(ICB)治疗的总体响应水平不足3成,部分ICB治疗后继可能因其他免疫检查点通路上调而产生耐药性,因此积极探索新靶点、探索多靶点联合治疗以扩大免疫疗法的适用范围,是当下最热门的研究方向。
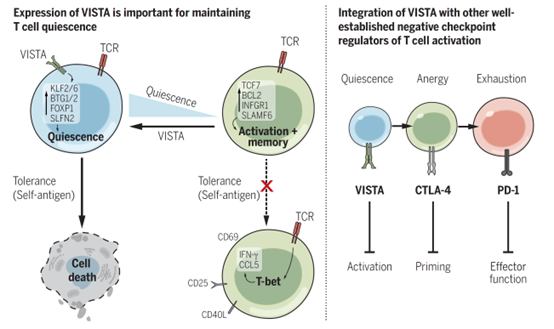
VISTA(V-domain Ig suppressor of T cell activation ,亦称PD-1H、B7-H5、Dies1、Gi24、DD1α)就是一个值得关注的抑制性免疫检查点,与CTLA-4、PD-1/PD-L1一样同属于B7家族分子,跟PD-L1具有较高的同源性但作用机制不同,可以组合治疗。相比那两个已在诺贝尔奖“扬名立万”的“同族”——CTLA-4表达于T细胞活化后不久,在T细胞致敏阶段限制协同刺激/抑制T细胞活化;PD-1表达于T细胞致敏后,在效应阶段抑制T细胞;VISTA很特别:以组成型表达于naïve T cell,能独立抑制T细胞活化以维持T细胞静息状态[1,2]——部分免疫阻断治疗耐药性案例中VISTA表达显著上调,可能是VISTA迫使T细胞进入静息状态而导致本该在T细胞活化阶段或效应阶段发挥作用的靶向抗体失去了“用武之地”。与外周淋巴结相比,VISTA 在肿瘤微环境 (TME) 中的MDSCs 中更丰富,在TME低氧环境下VISTA表达显著上调,可减少 TLR 信号传导和细胞迁移,通过重编程髓细胞减少TNF-α等促炎细胞因子、增加IL-10等抗炎介质来促进髓细胞免疫抑制功能;通过促进由激活诱导的T细胞死亡来提高外周免疫耐受[1,2]。
(左)VISTA缺失会降低初始 T 细胞在转录和表观遗传水平上的静息表型,导致 TCR 和细胞因子途径的增强破坏了对自身抗原的耐受性诱导,并在激活时赋予了更多的炎症表型。(右)VISTA 与CTLA-4和PD-1 负向检查点作用阶段不同。VISTA 在初始 T 细胞上组成型表达,并在强制静息中起关键作用。CTLA-4 在 T 细胞活化后短暂地在细胞表面表达,并通过限制共刺激在启动阶段抑制 T 细胞活化。PD-1 在启动后期表达并在效应器阶段抑制 T 细胞[1]。
在临床前研究中敲除VISTA基因或用抗体阻断VISTA会大大上调T细胞介导的抗肿瘤免疫力,导致抗原特异性T细胞显著扩增、对T细胞受体和细胞因子刺激产生更强的响应,免疫耐受性降低[1]。由于VISTA对维持初始T细胞静息和自身免疫耐受的稳定状态至关重要,可能是癌症免疫治疗以及自身免疫性疾病治疗中一个很有潜力的辅助治疗靶点。
人类VISTA已确认有两个具有免疫抑制功能的结合配体:VSIG3和PSGL-1 ,还有一个尚未确认的受体VSIG8[2,4,13,20,21]。VISTA与配体结合受环境pH值调节[5],并且信号传导可能是双向的, 在TME中pH约6.0的酸性条件下,VISTA与PSGL-1结合,在生理 pH下不结合[2,4,5,13,14,20,22,23]。pH和离子环境调节VISTA免疫受体相互作用是一个值得关注的新概念,启发了新的策略,如靶向pH异常区域(如肿瘤)的pH选择性抗体(正常条件不反应可减少副作用);靶向TME酸性的药物以降低酸性环境下免疫抑制活性并增强抗肿瘤免疫反应;以及pH选择性释放的药物载体等等,都可能成为检查点阻断疗法的协同治疗途径。
VSIG3属于Ig超家族成员,与多种粘附受体具有同源性,已知在胃癌细胞和肝癌细胞等肿瘤细胞中均表达[20]。PSGL-1是一种粘附分子,表达于白细胞表面,它与选择素和VISTA 的结合受糖基化和酪氨酸硫酸化的调节。PSGL-1本身就是个免疫治疗新靶点[39],2019年三生制药获得了Verseau旗下一个PSGL-1单抗在大中华地区的开发授权并于今年初申报临床。结构和突变分析表明,VISTA与VSIG3和PSGL-1的结合区域不同但有部分重叠[2]。
恶性肿瘤与免疫疗法中的 VISTA
VISTA广泛表达于髓系和淋巴细胞,特别是TME中的免疫细胞上。HIF-1α可上调VISTA表达,提示缺氧的TME可能会形成某种酸性生态位,使VISTA免疫抑制活性最大化而促进TME内的免疫抑制[6,16]。VISTA在多种实体瘤类型的TME髓源性抑制细胞中具更高表达,表明它可能参与抑制肿瘤浸润的效应T细胞,也表明VISTA协同阻断疗法可能具有广泛的临床适用性。小鼠模型中VISTA抑制性抗体处理后肿瘤浸润性T细胞的增殖、活化和效应功能增强支持这种假设[15]。因此,除了在免疫阻断治疗的获得性耐药性案例中VISTA上调可能代表某种重要潜在机制而受到关注[6,18],在临床上VISTA在胰腺癌、间皮瘤等多种恶性肿瘤类型中强烈表达,也比较引人关注。美国MD Anderson癌症中心研究发现胰腺癌中的免疫细胞尤其是浸润到胰腺癌的巨噬细胞表面有VISTA的过表达。他们认为PD-1和CTLA-4免疫疗法治疗胰腺癌无效的原因可能是VISTA通路还在发挥抑制免疫反应的作用,所以VISTA或有可能是胰腺癌潜在的协同治疗靶点[19]。
大多数描述有效 VISTA 治疗模型都依赖于组合方法,这可能是由于单一阻断VISTA通路虽然能解除对初始T细胞的抑制,但在T细胞致敏和效应阶段还有其他免疫检查点能发挥抑制作用。研究表明,多靶点联合治疗在多个阶段阻断对T细胞的免疫抑制可能是更为理想的策略:在CT26结肠癌小鼠模型中的靶向VISTA和PD-L1联合治疗导致所有治疗小鼠的肿瘤消退和长期存活,与任一单一疗法形成鲜明对比(VISTA mAb 单一疗法为12.5%,PD-L1单抗单一疗法为 37.5%);B16荷瘤小鼠经低剂量(250rads)照射和4剂量GM-CSF分泌细胞疫苗(GVAX)处理后,用VISTA和PD-L1单抗联合治疗显示出显著的生存优势和肿瘤根除率[2,15,11];
VISTA和PD-L1联合阻断在两种小鼠肿瘤模型(CT26结肠癌细胞接种和低免疫原性黑色素瘤模型)中获得最佳治疗效果 [17]
VISTA在自身免疫性疾病中的潜在作用
VISTA是负责调控T细胞对自身抗原免疫反应的关键,这对于自身免疫性疾病显然是一个重要靶点。多项动物实验表明,VISTA可抑制免疫细胞活化增殖,减少炎症介质的释放,缓解多种自身免疫性疾病,可作为一种潜在的免疫治疗靶点:
1 VISTA在人类系统性红斑狼疮 (SLE) 病变的免疫细胞上高表达。陈列平教授团队报告BALB/c小鼠模型敲除VISTA会自发发展出类似于人类狼疮的皮肤损伤和系统性自身免疫性疾病;用VISTA拮抗抗体会导致SLE小鼠模型促炎性反应增强、进程加重加快、生存时间缩短;用VISTA激动性抗体可明显缓解SLE小鼠模型的皮肤症状和炎症发生,减少自身抗体、炎性细胞因子、趋化因子和免疫细胞的扩增。这表明VISTA是狼疮发病机制和进展的关键因素,其激活有可能有助于恢复系统性患者的免疫平衡[7,8,9,10]。
2 在小鼠GVHD模型半异体和全异体移植两种条件下,单剂量VISTA激动剂抗体可完全预防GVHD并使小鼠长期存活率达到100%[24]。当用抗VISTA激动性抗体治疗OVA诱导的小鼠实验性哮喘时,可以显著减少BALF中炎症细胞的数量,尤其是嗜酸性粒细胞和淋巴细胞,以及肺部炎症和粘液产生[29]。
3 VISTA对银屑病的发生、发展具有抑制作用:VISTA基因敲除小鼠表出现外周耐受性丧失,自发性T细胞活化、炎性细胞因子和趋化因子的产生以及慢性多器官炎症;在IMQ诱导银屑病模型中VISTA基因敲除小鼠表现出显著更严重的症状;健康小鼠在注射拮抗性VISTA单抗后进行IMQ诱导银屑病也出现加剧的炎症症状但程度较基因敲除小鼠略轻,实验进一步证实VISTA在抑制IL-23/IL-17介导的炎症轴中起关键作用[25]。
4 在刀豆蛋白A诱导的自身免疫性肝炎小鼠模型中,VISTA敲除小鼠对诱导的敏感性增加,肝脏内免疫细胞过度活化,炎症因子水平显著升高和死亡率增加,而Con A诱导前给予激动性VISTA单抗可有效保护小鼠,减轻炎性水平,降低死亡率[12];
5 在实验性自身免疫性脑脊髓炎(EAE)小鼠模型中,敲除VISTA基因显著提高EAE小鼠疾病发病率、死亡率和发病强度[11],加剧自身免疫性疾病的发展。
这些实验结果从不同角度表明,VISTA负责在耐受性条件下抑制T细胞扩增/活化,调节耐受性内源抗原特异性T细胞的命运,VISTA基因缺失可预测多种人类自身免疫性疾病,VISTA靶点在自身免疫性疾病和器官移植中具有应用潜力[1]。针对VISTA靶点的药物开发在肿瘤免疫治疗和自身免疫疾病治疗都很值得期待。
临床药物开发一览
靶向VISTA的药物开发有拮抗剂和激动剂两种不同方向。最受关注的当然还是肿瘤免疫治疗,VISTA拮抗剂已有小分子拮抗剂和单克隆抗体两种类型进入临床I/II期研究。
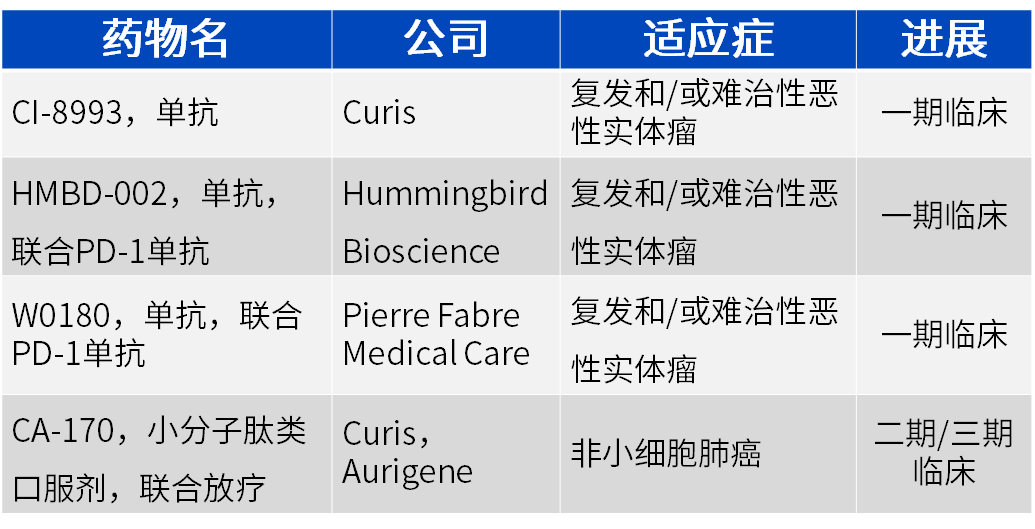
进入临床试验的候选VISTA拮抗剂
靶向VISTA的小分子抑制剂
CA-170是一种选择性靶向PD-L1和VISTA的口服小分子肽类双重拮抗剂,作为PD-L1和VISTA双靶点抑制剂正在进行临床II期实验。VISTA与PD-L1具有结构相似性,在不同阶段抑制T细胞功能。临床前数据显示,CA-170在多种肿瘤模型中表现出了类似抗PD-1或VISTA抗体的抗肿瘤作用。I期临床(NCT02812875)中CA-170可接受的口服安全剂量达1200mg BID[27]。
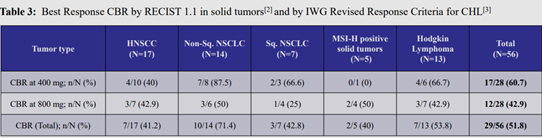
2019年Aurigene在EMSO上公布CA-170治疗多种类型肿瘤(包括头颈部鳞状细胞癌,非鳞非小细胞肺癌nsNSCLC,MSI-H阳性实体瘤和霍奇金淋巴瘤)患者的IIa期临床数据。CA-170显示出良好的安全性和有效性,总体临床获益率 51.8%,其中nsNSCLC的临床获益率>70%,数据相当亮眼[27,28]。由于数据支持CA-170有希望成为nsNSCLC的治疗选择,2020年初Curis宣布由合作方Aurigene资助并在印度主要癌症治疗中心开展一项IIb/III期随机研究,在约240例nsNSCLC患者中评估CA-170联合放化疗的疗效。
几种实体瘤患者口服CA-170 400mg和800mg组的临床获益率(CBR)(来源:Curis/Aurigene在欧洲肿瘤学会2019年会发布的IIa期临床数据报告[27])
拮抗性单克隆抗体
1 CI-8993是一种拮抗VISTA的、具有活性Fc的单克隆IgG1κ抗体。临床前研究表明,CI-8993能增加外周肿瘤特异性T细胞数量,增强TME中肿瘤反应性T细胞的浸润、增殖和效应功能;可通过减少髓源性免疫抑制单核细胞和粒细胞、增加TME中活化DC细胞来改变TME的抑制特征,从而增强T细胞介导的免疫反应。CI-8993作为单一疗法能够抑制可移植和可诱导黑色素瘤的生长[28]。
CI-8993(曾用名JNJ-61610588,VSTB112)最初由ImmuNext和Janssen合作开发。2016年Janssen在评估其在晚期实体肿瘤患者中剂量和药代动力学/药效的1期临床研究中招募了12名患者,其中一位患者出现了与细胞因子释放综合征相关的短暂剂量限值副作用,Janssen以“商业原因”选择终止这项研究。后来Curis从ImmuNext 获得这个VISTA单抗用于癌症治疗的开发和商业化独家授权[28]。
2022年1月Curis公布CI-8993用于复发或难治性实体肿瘤的1期单药治疗研究(NCT04475523)结果,13例患者在0.15mg/kg和0.3mg/kg剂量组(即Janssen终止项目前所研究的剂量水平)显示出了良好的安全性,没有观察到剂量限制毒性。药效学(PD)效应表明CI-8993可能会激活多种抗癌免疫机制,药代动力学(PK)数据表明在较高剂量水平下可能具有较高生物利用度,Curis目前正在招募50例转移性或不可切除、复发和/或难治性恶性实体瘤(非淋巴瘤)患者,以确定全剂量CI-8993的最大耐受剂量(MTD),探索更高剂量下的PK/PD关系(入组浓度0.6 mg/kg)。预计将在 2022 年下半年报告扩展数据。
2 HMBD-002单抗是Hummingbird Bioscience开发的第一个不依赖 Fc的IgG4型拮抗性抗VISTA单克隆抗体。有趣的是,这个抗体是由AI指导开发,靶向 VISTA特有C-C' 环上一个保守的特定功能表位。HMBD-002单抗可阻断 VISTA与潜在配体间的相互作用,解除对T细胞活性的抑制,在小鼠模型中促使TME向抗肿瘤表型重塑,向以Th1/Th17反应为特征的促炎性表型的明显转变,在临床前结直肠癌、肺癌和乳腺癌的人源化小鼠癌症模型中表现出对肿瘤生长的有效抑制。Hummingbird于2021年10月启动多中心的1/2期临床试验(NCT05082610),正在招募240恶性实体瘤患者。I期临床主要目标是确定HMBD-002作为单一药物以及联合抗PD -1单抗Pembrolizumab在晚期实体恶性肿瘤患者中的推荐II期剂量(RP2D)。II期临床计划将对HMBD-002单独或联合PD -1单抗在三阴性乳腺癌、非小细胞肺癌和其他已知表达VISTA的恶性肿瘤患者中进行评估[34,35,36,37,38]。
3 W0180(K01401-020)是Pierre Fabre Medical Care研发团队开发的靶向VISTA单克隆抗体。体外实验表明W0180刺激 NK 细胞增殖并诱导NK 细胞和单核细胞激活细胞因子,促进 T 细胞活化。临床前研究表明,在非人类灵长类动物中W0180单抗单一输注治疗可潜在地产生针对外源性抗原的特异性CD8+ T细胞反应,有效增强 CD8+ T细胞对肿瘤抗原的活性[13]。2020年9月Pierre Fabre启动I期临床(NCT04564417),正在招募69名难治性晚期或转移性实体瘤患者,主要目标是研究W0180单一用药或者联合PD-1抗体Pembrolizumab的最大耐受量(MTD)和剂量限值毒性(DLTs)。2022年6月Pierre Fabre宣布委托Lonza为其生产W0180单抗。
4 SG7单抗是斯坦福大学研究人员用酵母表面展示设计构建的一种拮抗性VISTA 抗体,与人类、小鼠食蟹猴 VISTA 具有高亲和力,与CI-8993(即VSTB112)竞争VISTA结合,可阻断VISTA与PSGL-1和VSIG3蛋白的相互作用并抑制其功能。在小鼠实验中,SG7可在多种同系小鼠模型中减缓肿瘤生长(与抗 PD1 联合使用),抑制 VISTA并帮助恢复正常T 细胞活化,可作为一种潜在的临床候选药物。SG7尚未进入临床药物试验[2,14]。
5 P1-068767 (BMS-767)是拮抗性VISTA单抗,是一个pH值选择性阻断抗体,仅在pH6.0时选择性阻断PSGL-1与VISTA相互作用,足以在体内逆转VISTA介导的免疫抑制。BMS-767可以在低pH值下进入肿瘤部位,从而可能减少任何非肿瘤反应性和不利影响。BMS-767被百时美施贵宝收入旗下,尚未进入临床药物试验阶段[2,4,5,23]。
虽然目前根据国内的临床药物开发试验登记信息,国内尚无针对VISTA靶点药物进入了临床试验阶段,但苏州思坦维公司官网显示有一项针对VISTA靶点抗体药的临床前研发项目,以及可在国家知识产权局看到有多项VISTA抗体专利,这些间接提示了当下国内VISTA靶点药物开发局面:方兴未艾,未来可期。如前所述,大多数描述有效 VISTA 治疗模型都依赖于组合方法,可以预见围绕VISTA靶点药物开发未来在多靶点协同治疗方向应该会有所突破。
激动性VISTA靶点药物开发:随着免疫检查点阻断治疗在癌症领域的大热,免疫检查点激活疗法在自身免疫病治疗和器官移植领域应用也开始受到关注。虽然目前尚未有激动性VISTA靶点候选药物进入临床试验阶段的记录,但这片未开垦之地的一角已经悄然揭开。作为目前唯一已知的组成型表达于初始T细胞的免疫检查点、负责维持免疫耐受和免疫稳态的VISTA在自身免疫病治疗中作为协同治疗的潜力是应予以关注。
除了PD-1/PD-L1和CTLA-4,越来越多免疫检查点成为研发热点。LAG-3抑制剂Relatlimab今年已经获批与PD-1抗体nivolumab以固定剂量联合治疗黑色素瘤。面对肿瘤细胞的复杂多变性,单兵作战往往难以“一招致命”,多靶点联合免疫疗法应有更大机会使患者受益。VISTA独特的分子机制明显区别于已经大热的免疫检查点,是否在临床上与其它靶点联合应用是安全有效的,以及未来究竟谁能在VISTA药物开发中这一新赛道产生里程碑式的新突破,我们将拭目以待。
结语
Abcam提供3个VISTA重组兔单克隆抗体(RabMAb®),见下表。

其具有高特异性、高灵敏度和高批间稳定性等优势,同时,Abcam 还可以针对药企/诊断公司个性化的需求,使用行业引领的兔杂交瘤抗体开发专利技术,为您提供包括 VISTA在内的各种抗体原料。
Abcam 现拥有兔杂交瘤(Hybridoma)、B 细胞克隆(B-cell cloning)以及基于二代测序技术(NGS)的三大兔单克隆抗体(RabMAb®)开发平台,全面契合药企/诊断公司的各种需求,例如诊断抗体(CDx)、抗体药物筛选及验证抗体(ADA/PK/PD)以及抗体药物前体发现 (Drug candidate discovery)等。我们共同期待兔单抗技术继续发挥其独有的优势,创造新的辉煌。与您携手,共创未来。
参考文献
1) Eltanbouly M A, Zhao Y, Nowak E C, et al. VISTA is a checkpoint regulator for naïve T cell quiescence and peripheral tolerance. Science, 2020, 367(6475)
2) Long Yuan,Jahnavi Tatineni,et al. VISTA: A Mediator of Quiescence and a Promising Target in Cancer Immunotherapy. Trends in Immunology :January 22, 2021 DOI:https://doi.org/10.1016/j.it.2020.12.008
3) Xin Chen, Xiaomin Song,i,et al. FcγR-Binding Is an Important Functional Attribute for Immune Checkpoint Antibodies in Cancer Immunotherapy. https://www.frontiersin.org/articles/10.3389/fimmu.2019.00292/full
4) Moustafa T. Gabr and Sanjiv S. Gambhir. Discovery and Optimization of Small-Molecule Ligands for V-Domain Ig Suppressor of T-Cell Activation (VISTA) J. Am. Chem. Soc. 2020, 142, 38, 16194–16198
5) Johnston R J, Su L J, Pinckney J, et al. VISTA is an acidic pH-selective ligand for PSGL-1. Nature, 2019, 574(7779): 565-570
6) Xu W,et al. Immune checkpoint protein VISTA regulates anti-tumor immunity by controlling myeloid cell-mediated inflammation and immunosuppression . Cancer Immunol Res,2019,7(9):1497-1510. DOI:10.1158/2326-6066.CIR-18-0489.
7) Han X,et al. PD-1H(VISTA)mediated suppression of autoimmunity in systemic and cutaneous lupus erythematosus. Sci Transl Med,2019,11(522):1-15.DOI:10.1126/scitranslmed.aax1159.
8) Ceeraz S,et al. VISTA deficiency accelerates the development of fatal murine lupus nephritis. Arthritis Rheumatol,2017,69(4):814-825.DOI:10.1002/art.40020.
9) Ceeraz S,et al. VISTA deficiency attenuates antibody-induced arthritis and alters macrophage gene expression inresponse to simulated immune complexes. Arthritis Res Ther,2017,19(1):270.DOI:10.1186/s13075-017-1474-y.
10) SERGENTPA,et al. Blocking the VISTA pathway enhances disease progressionin(NZB×NZW)F1 female mice. Lupus,2018,27(2):210-216.DOI:10.1177/0961203317716322.
11) Wang L,et al. Disruption of the immune-checkpoint VISTA gene imparts a proinflammatory phenotype with predisposition to the development of autoimmunity. PNAS. USA,2014,111(41):14846-14851.DOI:10.1073/pnas.1407447111.
12) Dallas B. Flies, Han X, et al. Coinhibitory receptor PD-1H preferentially suppresses CD4+T cell-mediated immunity. J Clin Invest,2014,124(5):1966-1975. .
13) Cruzalegui, ,et al. VISTA interaction with PSGL1, a likely VISTA receptor in tumors, is effectively disrupted by K0401-020 anti-VISTA antibody. CANCER RESEARCH, 2020; 80 (16):
14) Mehta, N., et al. An engineered antibody binds a distinct epitope and is a potent inhibitor of murine and human VISTA. Sci Rep 10, 15171 (2020);
15) Isabelle Le Mercier; Li Wang,et al. VISTA Regulates the Development of Protective Antitumor Immunity. Cancer Res (2014) 74 (7): 1933–1944
16) Deng J. et al. Hypoxia-induced VISTA promotes the suppressive function of myeloid-derived suppressor cells in the tumor microenvironment. Cancer Immunol. Res. 2019; 7: 1079-1090
17) Liu J, et al Immune-checkpoint proteins VISTA and PD-1 nonredundantly regulate murine T-cell responses. PNAS 2015;112:6682–7.
18) Kakavand, H., Jackett, L., Menzies, A. et al. Negative immune checkpoint regulation by VISTA: a mechanism of acquired resistance to anti-PD-1 therapy in metastatic melanoma patients. Mod Pathol 30, 1666–1676 (2017). https://doi.org/10.1038/modpathol.2017.89
19) Jorge Blando, el at. Comparison of immune infiltrates in melanoma and pancreatic cancer highlights VISTA as a potential target in pancreatic cancer. PNAS 116 (5) 1692-1697 https://doi.org/10.1073/pnas.1811067116
20) Wang J. et al. VSIG-3 as a ligand of VISTA inhibits human T-cell function. Immunology. 2019; 156: 74-85
21) Molloy, M. et al. Immunext Inc. Identification of VSIG-8 as the putative VISTA receptor and its use thereof to produce VISTA/VSIG-8 modulators, WO 2016/090347 A1
22) Pouyani T. Seed B. PSGL-1 recognition of P-selectin is controlled by a tyrosine sulfation consensus at the PSGL-1 amino terminus. Cell. 1995; 83: 333-343
23) Mahoney K.M. Freeman G.J. Acidity changes immunology: a new VISTA pathway. Nat. Immunol. 2020; 21: 13-16
24) Dallas B. Flies, Shengdian Wang, Haiying Xu and Lieping Chen. A Monoclonal Antibody Specific for the Programmed Death-1 Homolog Prevents Graft-versus-Host Disease in Mouse Models. J Immunol August 15, 2011, 187 (4) 1537-1541; DOI: https://doi.org/10.4049/jimmunol.1100660
25) Li N,Xu W,et al. Immune-checkpoint protein VISTA critically regulates the IL-23/IL-17 inflammatory axis. SciRep,2017,7(1):1-11.DOI:10.1038/s41598-017-01411-1
26) https://www.curis.com/pipeline/ca-170/
27) https://www.curis.com/wp-content/uploads/2019/10/ESMO2019CA-170.pdf
28) https://www.curis.com/pipeline/ci-8993/
29) Huafeng Liu, Xin Li, Li Hu, Min Zhu, Bailin He, Liqun Luo & Lieping Chen. A crucial role of the PD-1H coinhibitory receptor in suppressing experimental asthma. Cellular & Molecular Immunology volume 15, pages838–845 (2018)
30) Xie S. et al. Expression of the inhibitory B7 family molecule VISTA in human colorectal carcinoma tumors. Cancer Immunol. Immunother. 2018; 67: 1685-1694
31) Zong L, et al. VISTA expression is associated with a favorable prognosis in patients with high-grade serous ovarian cancer. Cancer Immunol Immunother. 2020 Jan;69(1):33-42. doi: 10.1007/s00262-019-02434-5. Epub 2019 Nov 28.
32) Kuklinski LF, et al. VISTA expression on tumor-infiltrating inflammatory cells in primary cutaneous melanoma correlates with poor disease-specific survival. Cancer Immunol Immunother. 2018 Jul;67(7):1113-1121. doi: 10.1007/s00262-018-2169-1. Epub 2018 May 8.
33) Hong S. et al. Analysis of VISTA expression and function in renal cell carcinoma highlights VISTA as a potential target for immunotherapy. Protein Cell. 2019; 10: 840-845
34) A Phase 1 First-in-Human study of HMBD-002, an IgG4 monoclonal antibody targeting VISTA, as a monotherapy and combined with pembrolizumab in patients with advanced solid malignancies. SITC 2021:
35) HMBD-002 is a novel, neutralizing, anti-VISTA antibody exhibiting strong preclinical efficacy and safety, being developed as a monotherapy and in combination with pembrolizumab. ASCO 2021:
36) HMBD-002-V4: A novel anti-VISTA antibody that uniquely binds murine and human VISTA and potently inhibits tumor growth by remodeling the immunosuppressive tumor microenvironment. Journal for ImmunoTherapy of Cancer: P477
37) Integrative immune profiling of syngeneic tumor models provides predictive immune signatures for treatment response with HMBD-002, a novel anti-VISTA neutralizing antibody. Cancer Research, Volume 78, Issue 13, Supplement, AACR Journals
38) HMBD-002, a novel neutralizing antibody targeting a specific epitope on the co-inhibitory immune checkpoint receptor VISTA, displays potent anti-tumor effects in pre-clinical models. Cancer Research, Volume 77, Issue 13, AACR Journals
39) Tinoco R. et al. PSGL-1 is an immune checkpoint regulator that promotes T cell exhaustion. Immunity. 2016; 44: 1190-1203




 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发