有肮脏,也有无奈。长生生物疫苗事件反思
| 导读 | 据国务院调查组消息,长春长生公司违法违规生产狂犬病疫苗案件调查工作取得重大进展,已基本查清企业违法违规生产狂犬病疫苗的事实。01新闻回顾据新华社记者报道,在现场,该企业的相关文件已被查封;调查组询问相关人员的书证34份,取证材料1138页,利用查获的计算机还原了实际生产记录和伪造的生产记录。公安机 |
据国务院调查组消息,长春长生公司违法违规生产狂犬病疫苗案件调查工作取得重大进展,已基本查清企业违法违规生产狂犬病疫苗的事实。
01
新闻回顾
据新华社记者报道,在现场,该企业的相关文件已被查封;调查组询问相关人员的书证34份,取证材料1138页,利用查获的计算机还原了实际生产记录和伪造的生产记录。公安机关已追回犯罪嫌疑人丢弃并意图损毁的60块电脑硬盘。
按照有关规定,疫苗生产应当按批准的工艺流程在一个连续的生产过程内进行。但该企业为降低成本、提高狂犬病疫苗生产成功率,违反批准的生产工艺组织生产,包括:
● 使用不同批次原液勾兑进行产品分装;
● 对原液勾兑后进行二次浓缩和纯化处理;
● 个别批次产品使用超过规定有效期的原液生产成品制剂;
● 虚假标注制剂产品生产日期;
● 生产结束后的小鼠攻毒试验改为在原液生产阶段进行。
为掩盖上述违法违规行为,企业有系统地编造生产、检验记录,开具填写虚假日期的小鼠购买发票,以应付监管部门检查。
7月6日至8日,药品监管部门对长春长生公司进行飞行检查时,发现企业违法违规生产行为,随即责令企业停产。此后,长春长生公司为掩盖事实,对内部监控录像储存卡、部分计算机硬盘进行了更换、处理,销毁相关证据。7月15日,国家药监局检查组再次进驻长春长生公司进行调查。
公安机关已对长春长生公司违法违规生产狂犬病疫苗案件开展立案侦查。截至25日,公安机关依法对长春长生公司董事长高某芳等16名涉嫌犯罪人员刑事拘留,冻结涉案的企业账户、个人账户。案件侦办工作正在进行中。
另据中国疾病预防控制中心不良反应监测数据,近几年注射狂犬病疫苗不良反应未见异常。长春长生公司生产的狂犬病疫苗接种后不良反应发生率为万分之0.2,未见严重不良反应。2017年我国狂犬病发病人数为516人,近几年呈逐年下降趋势。
02
长生生物做了哪些违规动作?
伪造记录、违规勾兑、过期使用、试验造假。
我们最熟悉的“原液勾兑”一词,最常、也最早见于工业制造中,比如酿酒、酿醋、酿酱油等。原液用于描述某种工业原料浓缩液体的母体。在酿酒业中意指原浆,未加勾兑的酒。
其实,“勾兑”一开始并非贬义,它是白酒酿造的一项非常重要而且必不可少的工艺。酒厂所生产的原酒,哪怕是同一批次,同一个窖池,蒸馏出来的酒也不同,为了能够保证出厂成品酒的品质稳定,就必须通过勾兑,实现统一酒质,并且提高酒质。
没有经过勾兑的原液,是没法喝的。
但现在,勾兑被人们几乎等同于掺兑、掺假。
疫苗制造中,就和白酒一样,也有勾兑。
以流感病毒为例。
● 流感疫苗生产车间里,在疫苗原液中加入灭活剂,去除病毒的致病力,保留刺激人体产生抗体的那部分。还要对病毒灭活液进行纯化,避免杂质使人体产生不良反应。
● 纯化后的疫苗原液就像刚酿出的白酒,度数高,并且纯,不适合饮用,必须加入水和其他东西勾兑到一定度数。疫苗原液也需要加入缓冲液稀释和佐剂“勾兑”到合适的浓度。
● 分装间是整个生产线对环境要求最严的,透过封闭玻璃窗,看到全身包裹得严严实实、只露出两只眼睛的工作人员正在操作机器,将疫苗液体打入瓶中。而这些小瓶已经事先在隔壁房间经过了冲水清洗、350摄氏度杀菌干燥等一系列“考验”。
●为了保证运输过程安全,疫苗的装箱可谓繁复。已经塑封好的20支装的流感疫苗,首先装进一个像摄影包一样的粉色包中,几个粉色包一起装进一个塑料袋,再将塑料袋装进纸箱,最后将封闭好的纸箱放进泡沫箱。
● 加盖上胶塞的疫苗经传送带进入外包装间,再逐一检验,贴标签,加上说明书装进小纸盒。(以上资料来自中国证券网-上海证券报,2009年09月17日)
勾兑必须符合生产工艺,更不能变成掺兑、掺假。
白酒被“勾兑”成白水,那还是酒吗?
规定效价的疫苗,被“勾兑”成低效价的疫苗,这样的疫苗还有用吗?而且还有些是过期的!
难怪接种后不良反应发生率为万分之0.2,未见严重不良反应。
企业的勇气和胆量是哪里来的?企业规避违法违规的手段是如何获得的?企业大规模造假是如何隐藏的?多次长期造假而没有足够犯罪成本是谁的责任?
而网络的爆料流出,高俊芳的儿媳超出想象的奢侈糜烂生活,各种炫富技能,让网友看的惊叹不已。



各种名牌包包摆满地,不同牌子的豪车。
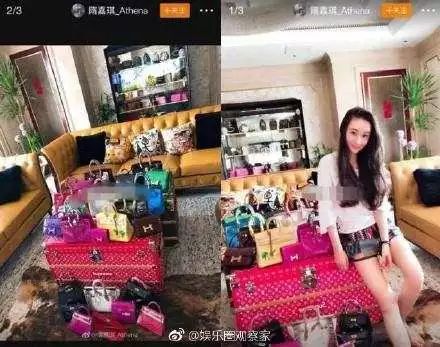
很难不让人不把这种奢靡和造假联系在一起。对于恪守职业准则,赚良心钱的商家,值得社会尊敬,而这样的人也很少会炫富。那些突破道德底线,赚人命钱的商家,利益高于一切。失去了做人的准则,那高调炫富,毫不为奇。
03
金钱、时间
疫苗工艺造假动机,值得深思。
有肮脏,也有无奈。
国家药监局负责人说,长生生物“编造生产记录和产品检验记录,随意变更工艺参数和设备”。伪造记录、违规勾兑、过期使用、试验造假,这就是赤裸裸的肮脏,很多时候,就是追求更大的利润空间。
大连金港安迪公司2008年的疫苗造假,违规添加核酸物质作为佐剂, 为企业降低三分之一到一半的成本。
然而,在部分行业内人士看来,也许也是一种无奈之举。
一位医药政策专家说:“这是个无奈的事情——当然也有肮脏的事儿,但肮脏却不是事情的全部。”
部分制药企业的药品注册工艺与实际生产工艺并不一致,陷入到“‘法规要求必须一致’与‘客观上就是无法一致’这一近乎绝望的无奈中”——一份有关“药品注册申报工艺与生产工艺一致性”的培训班招生简章里这样写道。训主办方是中国化工企业管理协会医药化工专业委员会。
事实上,这类针对行业人士的培训班数量众多,以期帮助从业者解决工艺不一致的问题——这也可以反映出这一问题的普遍性。
药品标准不断提升,按原有工艺,药厂无法再生产出符合要求的产品,也是药厂必须调整工艺的原因之一。以新标准设立的药厂,并无太大动机来私自调整工艺,但那些有着历史包袱的老厂,必然面临调整工艺的压力。
以陷入生产记录造假的“冻干人用狂犬病疫苗(Vero细胞)”为例,药典中对“细菌内毒素”一项指标有要求,这个标准是一再提高:2005版药典中,要求“应不高于100EU/剂”;而到了2010版药典,这一指标提升到“应不高于50EU/剂”;在最新2015版药典中,指标进一步严格到“应不高于25EU/剂”。
另一种情况是:药厂可能会随着监管部门变更指标的执行尺度而调整工艺。中检院在2009年4月发出通知,增加DNA残留量及其他几项检验要求,表示 “达不到规程要求的(疫苗产品)将不予签发”。
这些规定使得部分在售疫苗不得不退出市场。疫苗厂家“依生制药”在一份情况说明中表示,2009年国内所有上市销售的狂犬疫苗中,仅有竞争对手“成大生物”一家完全达到监管要求。
业内人士此前曾建议,对于“因药典标准变化、技术要求提升等非企业主观原因”造成的工艺不一致,药监部门应当考虑“简化补充申请技术要求”。
为什么药厂不通过正常渠道报批变更工艺呢?
药监部门的说法是,希望改工艺的药厂得一步步按规矩来。
针对实际工艺与注册工艺不同的问题,中国药监部门在2016年下发通知,要求对药品生产工艺展开核对——化学药、中药及生物制品均包括在内。
2007年《药品注册管理办法》完成修订。药监部门认为,“此后批准上市的绝大多数药品的实际生产工艺与批准的生产工艺是一致的”。但“部分2007前批准上市的品种未按照批准的生产工艺组织生产、改变生产工艺未按规定研究和申报”。
原国家食药监总局在2016年要求企业开展自查,若现实工艺与注册工艺不符,须进行研究验证。
行政文件要求,若生产工艺变化不影响药品质量,制药企业应提出补充申请,经国家药监部门的技术评审后,由后者做出审批决定。若影响药品质量,“企业应立即停产”,并提出补充申请,获批后才能继续生产。
监管者为药厂下达了最后时限,对于在产药品,药厂得在2017年6月底前完成工艺研究验证并提交补充申请;对于非在产药品,这一时限推迟至当年年底。
按监管规定,变更生产工艺属药品上市后补充申请范畴。疫苗厂家变更工艺,大多数属于“对药品安全性、有效性和质量可控性可能具有中等程度影响”或者“显著影响”的变更——须得由监管部门批准。
同时,国家药监局还对包括疫苗在内的生物制品生产工艺过程变更出台了专门的技术指导原则,就原辅材料、菌毒种库及细胞库、生产工艺等各个环节可能涉及到的变更提出了审批要求。
尽管监管规定中,国家药监局对药品上市后相关变更的审批时限为30-60个工作日不等——药品关乎公众健康,这一时限并不长——但事实上,药厂须得花上长得多的时间,以开展研究验证并准备申请资料,“申报流程耗时数年”。
“生产流程必须停止,时间成本和金钱耗费堪比研发新药”,一位行业人士表示,此外“还得倒查过去数据的真实性”。这使得很大的数量药厂一方面“禁不起工艺核查”,另一方面“又不敢申报注册工艺变更”。
有没有不停产而变更工艺的可能性?有,但门槛并不低。按监管要求,只有在2007年前发生工艺变更,生产正常,工艺稳定,未发现安全性及有效性问题,以及变更后“生产工艺属于技术进步或创新”的更变才可在不停产的前提下提出补充申请。
对于实际生产工艺与注册不符的情况,一位制药行业人士在社交平台上说,“等着吃牢饭吧”,他补充道,药监局对于这种情况通常无能为力,但“有人举报就麻烦了”。7月23日,长生生物被立案调查。
然而,也有业内人士对疫苗厂家“无奈造假”的说法表示不屑。一位疫苗研究专家坦言,“每五年还有一次再注册申请,他们完全可以利用这个机会调整生产工艺”。按监管要求,再注册申请可以让药品上市许可持有人,在药品批准文件有效期满后,继续持有该药品。

尽管有肮脏,也有无奈。但无论何时,都不能视人的性命为儿戏。那些心怀侥幸之人,终将无法逃脱被人民审判的命运。
本次疫苗事件之后,最提心吊胆的就是千千万万的父母,尤其那些接触问题疫苗的家长,可能每分每秒都活在焦虑中!!!
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录

还没有人评论,赶快抢个沙发