葛均波院士/孙爱军教授团队揭示心梗再灌注损伤核心机制:ZBP1驱动心肌细胞泛凋亡,靶向小分子药物精准阻断提供全新治疗靶点
| 导读 | 研究人员还筛选出一种小分子药物MSB,能精准阻断ZBP1的死亡指令,为心梗治疗提供了全新靶点。 |
心梗是全球心血管疾病患者的致命杀手——全球每年约1800万人死于心梗,而即使通过支架植入等再灌注治疗快速开通堵塞血管,仍有近30%的患者因再灌注损伤陷入心衰甚至死亡。这种开通血管反而加重损伤的矛盾,长期困扰着心血管领域。
近日,复旦大学附属中山医院葛均波院士/孙爱军教授团队发表于国际权威期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)的一项研究,终于揭开了再灌注损伤的关键幕后黑手:Z-DNA结合蛋白1(ZBP1)——这个原本被认为是免疫系统病毒传感器的蛋白,竟会在心肌缺血再灌注时“叛变”,诱导心肌细胞发生一种融合凋亡、坏死、焦亡的泛凋亡模式,直接加剧心脏损伤。研究人员还筛选出一种小分子药物MSB,能精准阻断ZBP1的死亡指令,为心梗治疗提供了全新靶点。

ZBP1通过形成ZBP1/RIPK3/CASP6/CASP8复合物驱动心肌细胞泛凋亡
再灌注损伤的核心痛点:多种细胞死亡协同

整合生物信息学分析确定了ZBP1在心肌缺血再灌注损伤中的关键作用
心梗发生后,血管堵塞导致心肌细胞缺血缺氧;而当支架开通血管,血流恢复的瞬间,大量氧自由基、炎症因子涌入,反而会触发心肌细胞的程序性死亡——这是再灌注损伤的核心病理。过去十年,科学家发现心肌细胞并非只发生单一的凋亡或坏死,而是多种死亡模式交织:凋亡(有序“自杀”)、坏死(被动“破裂”)、焦亡(炎症性“爆炸”)同时启动,形成一种名为PANoptosis(泛凋亡)的协同死亡网络。这种模式比单一细胞死亡更难抑制——阻断其中一类,另一类会补位,导致损伤持续放大。要解决问题,必须找到幕后指挥——那个同时调动所有死亡模式的关键分子。
ZBP1:从免疫传感器到死亡指挥官的反转

ZBP1敲低可减轻缺氧复氧应激后心肌细胞的焦亡、凋亡和坏死

心肌细胞特异性ZBP1缺陷可改善体内缺血再灌注诱导的心肌损伤
ZBP1的身份反转,是这项研究最意外的发现。作为先天免疫系统的哨兵,ZBP1原本的功能是识别病毒或受损细胞的DNA,激活炎症反应对抗病原体。但在这项研究中,团队通过动态转录组分析发现:小鼠心梗再灌注后,ZBP1的mRNA和蛋白水平在缺血区域显著上调——而且这些ZBP1几乎全部来自心肌细胞本身,而非免疫细胞。研究团队原本以为ZBP1是通过激活免疫反应间接损伤心肌,但实验发现,即使没有免疫细胞参与,ZBP1升高也会直接诱导心肌细胞死亡。为了验证这一点,团队做了两组关键实验:
-
细胞层面:用缺氧复氧(模拟再灌注)处理成年心肌细胞,ZBP1水平随时间飙升,同时凋亡、坏死、焦亡的标志物全部上升;而敲除ZBP1后,这些死亡信号几乎完全被抑制。
-
动物层面:构建心肌细胞特异性ZBP1敲除小鼠(Zbp1fl/flMyh6+),再灌注后其心肌梗死面积比对照组小40%,心功能(左室射血分数)改善30%;相反,若让心肌细胞过表达ZBP1,即使没有缺血,小鼠也会出现心脏重构、纤维化,最终发展为心衰。
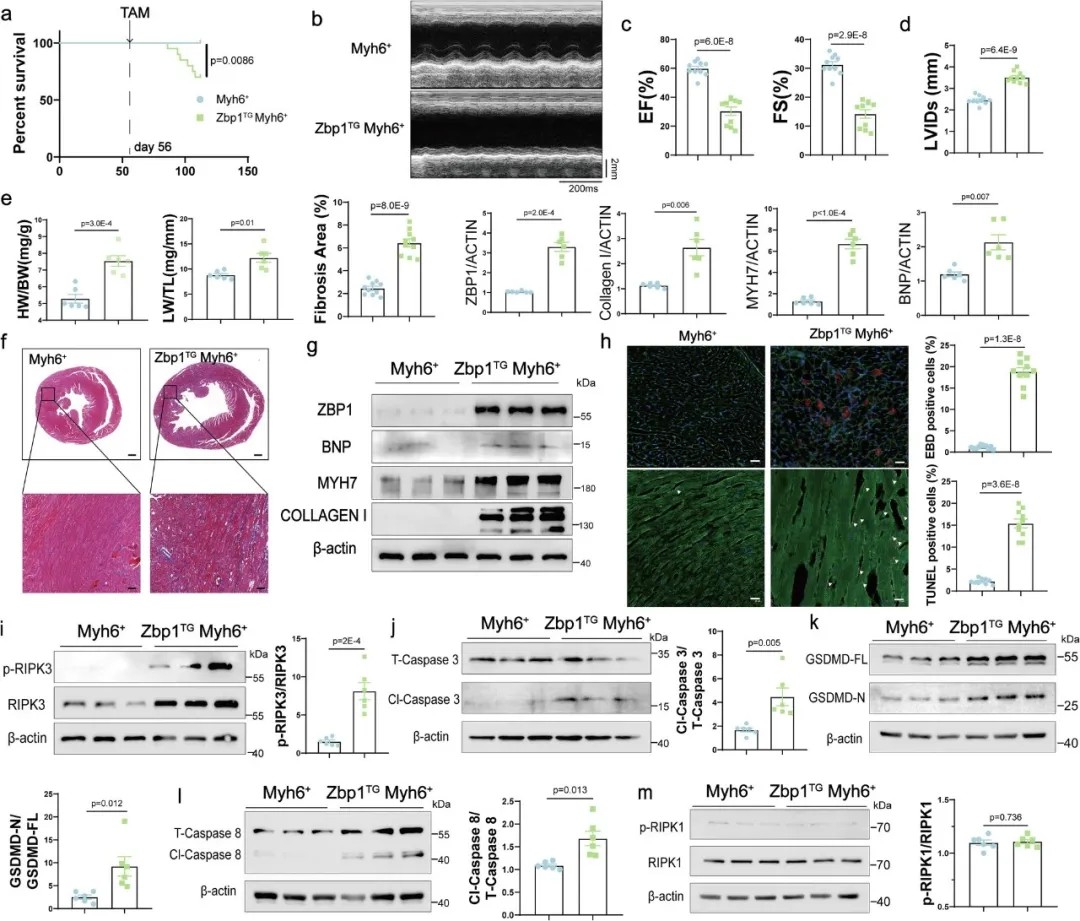
心肌细胞特异性过表达ZBP1会导致心脏重构和心力衰竭
机制揭秘:ZBP1组建死亡复合物,驱动泛凋亡

ZBP1通过调控非经典PANoptosome复合物组装诱导心肌细胞泛凋亡
ZBP1究竟是如何指挥多种细胞死亡?团队通过蛋白质互作分析找到了答案——ZBP1的RHIM结构域,会与RIPK3、CASP8、CASP6三种蛋白结合,形成非经典PANoptosome复合物。这个复合物就像一个死亡开关:激活CASP3,诱导凋亡;切割GSDMD,引发焦亡;激活RIPK3下游通路,导致坏死。
更关键的是,这个复合物不依赖传统的炎症小体,也不需要病毒DNA刺激——ZBP1本身就能组装并启动死亡程序。这解释了为什么再灌注时,即使没有外来病原体,心肌细胞也会发生大规模死亡。
既然ZBP1是核心靶点,如何阻断它的破坏行为?研究团队采用虚拟筛选+实验验证的策略,从30万种化合物中找到了MSB——这个小分子能精准结合ZBP1的RHIM结构域,破坏其与RIPK3、CASP8的互作,从而瓦解PANoptosome复合物。体内实验中,给再灌注损伤小鼠注射MSB(5mg/kg),24小时后:心肌梗死面积减少50%;血清LDH(细胞死亡标志物)水平下降60%;7天后心功能(EF值)改善25%,纤维化面积减少40%。
MSB的优势在于上游阻断——它不是抑制某一种细胞死亡,而是直接切断ZBP1的指挥链,同时抑制多种死亡模式,这比单一用凋亡抑制剂或坏死抑制剂更有效。

MSB是一种可保护免受心肌缺血再灌注损伤的新型ZBP1抑制剂
临床意义与未来展望
这项研究的价值,远不止于发现一个新蛋白——它重新定义了心梗再灌注损伤的机制,也为临床治疗提供了全新思路:
-
靶向ZBP1,避免治标不治本:过去抑制单一细胞死亡的方法,往往因其他死亡模式补位而失效;而抑制ZBP1,能从源头阻断整个PANoptosis网络。
-
MSB的转化潜力:作为小分子药物,MSB易于合成、给药方便,未来若进入临床试验,有望成为心梗再灌注治疗的辅助武器。
-
重新认识ZBP1的双重角色:ZBP1不仅在感染中起作用,在心肌损伤中也能变脸——这提示我们,针对免疫分子的靶向治疗,需要更精准地区分生理状态和病理状态。
对于心梗患者而言,这项研究的意义在于:曾经不可避免的再灌注损伤,如今终于有了可攻击的靶点;曾经单一无效的治疗策略,未来可能转向精准阻断。这项研究不仅填补了ZBP1在心肌细胞中功能的空白,更为心梗治疗提供了全新靶点和药物候选——它可能改变我们对再灌注损伤的认知。(转化医学网360zhyx.com)
原文链接:
https://www.nature.com/articles/s41392-025-02430-5
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发