破解免疫治疗耐药难题!郑小虎/田志刚/孙昊昱/马洪第等设计新型免疫分子,诱导Treg细胞脆化,显著抑制肿瘤生长
| 导读 | αTIGIT-IL2通过脆化肿瘤内Treg、激活中性粒细胞与T细胞的协同网络,这一创新疗法不仅突破了IL-2的治疗瓶颈,更为克服免疫治疗耐药开辟了新路径。 |
近日,中国科学技术大学郑小虎教授/田志刚院士/马洪第教授、复旦大学孙昊昱教授团队等联合在《Nature Communications》发表一项具有重要意义的肿瘤免疫治疗研究,成功开发出一种新型免疫细胞因子——αTIGIT-IL2。该分子通过精准制导肿瘤浸润调节性T细胞(Treg),诱导其进入脆化状态,削弱免疫抑制功能,同时激活中性粒细胞与CD8+ T细胞的协同杀伤,显著抑制包括三阴性乳腺癌(TNBC)在内的多种肿瘤生长,为克服免疫检查点抑制剂耐药提供了全新策略。
研究背景与设计

αTIGIT-IL2即使在免疫检查点抑制剂(ICB)治疗耐药的模型中仍表现出有效的肿瘤控制
白细胞介素-2(IL-2)是肿瘤免疫治疗的老将:低剂量可激活免疫,但易因过度扩增Treg细胞引发免疫耐受;高剂量虽能增强抗肿瘤免疫,却伴随严重毒性。如何扬长避短?研究团队瞄准Treg细胞的关键靶点——TIGIT(T细胞免疫球蛋白黏蛋白分子),设计出融合抗TIGIT单抗与IL-2的免疫细胞因子αTIGIT-IL2。研究团队希望它像智能导弹,既通过IL-2激活免疫,又通过TIGIT靶向肿瘤内Treg,打破其免疫抑制的保护壳。
核心机制与实验验证

αTIGIT-IL2向调节性T细胞(Treg)的靶向递送主要由其组成性高表达的CD25介导

αTIGIT-IL2将肿瘤浸润性调节性T细胞(Treg)重编程为脆弱样表型
实验显示,αTIGIT-IL2通过Treg细胞高表达的CD25受体实现精准递送,在肿瘤局部激活IL-2信号,而非全身扩散。在小鼠MC38结肠癌、B16F10黑色素瘤模型中,10μg/次的剂量即可有效控制肿瘤,且无明显肝毒性。
核心机制一:Treg脆化——从抑制到促炎的转身
肿瘤内Treg细胞被αTIGIT-IL2改造后,呈现脆化表型:抑制功能相关分子(Foxp3、CTLA-4、IL-10)表达下降,促炎因子(IFN-γ、TNF)显著上调。单细胞测序证实,这些脆化Treg属于新亚群,基因表达偏向激活淋巴细胞、分泌促炎因子。
有趣的是,这种脆化仅发生在肿瘤内。脾脏中的Treg因缺乏肿瘤微环境的高CD155(TIGIT配体)信号,未受显著影响,避免了全身免疫过度激活。
核心机制二:中性粒细胞再教育,激活CD8+ T细胞
脆化Treg与CD4+ T细胞分泌的IFN-γ和趋化因子,招募大量中性粒细胞进入肿瘤。这些中性粒细胞被重编程为高表达MHC I类分子的抗原呈递细胞(nAPC),通过与CD8+ T细胞的高频接触(空间距离缩短),激活其杀伤功能。
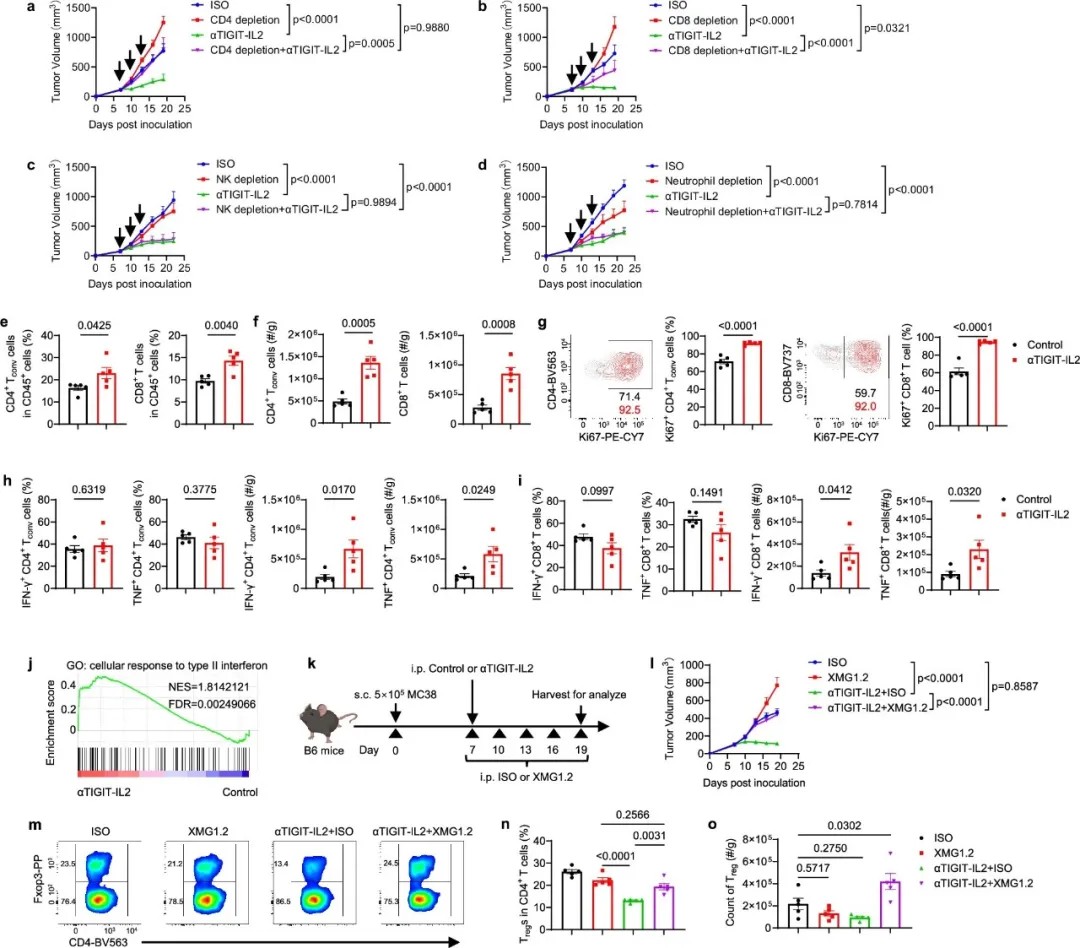
αTIGIT-IL2给药后,IFN-γ触发炎症性肿瘤微环境

αTIGIT-IL2激活的CD4+ T细胞增强中性粒细胞的抗原呈递功能并促进中性粒细胞与CD8+ T细胞的交流
研究团队观察到,治疗后肿瘤内CD8+ T细胞增殖加速,且对肿瘤抗原的识别能力增强。中性粒细胞不仅是炎症哨兵,更成为连接Treg与T细胞的桥梁。
针对临床难题——三阴性乳腺癌(TNBC)对免疫检查点抑制剂治疗的高耐药性,研究团队在EO771和4T1 TNBC模型中验证了αTIGIT-IL2的潜力:
-
单药治疗显著抑制肿瘤生长;
-
与PD-1抑制剂联用,EO771肿瘤完全消退,且治愈小鼠对肿瘤再挑战无复发;
-
4T1模型中,联合治疗使部分肿瘤退缩。
分析22例三阴性乳腺癌患者数据发现,免疫检查点抑制剂无应答者的Treg细胞更顽固(高表达FOXP3、TIGIT),而αTIGIT-IL2正是针对这一群体的克星。这提示该疗法可能成为三阴性乳腺癌对免疫检查点抑制剂耐药后的新选择。

αTIGIT-IL2消除三阴性乳腺癌(TNBC)对ICB治疗的耐药性,导致肿瘤消退
研究意义与未来展望
目前,团队已完成αTIGIT-IL2的临床前安全性评估,计划启动临床试验,重点探索其在PD-1耐药实体瘤中的应用。研究团队还在优化分子设计,例如通过前药策略限制其系统性激活,进一步降低毒性。αTIGIT-IL2通过脆化肿瘤内Treg、激活中性粒细胞与T细胞的协同网络,这一创新疗法不仅突破了IL-2的治疗瓶颈,更为克服免疫治疗耐药开辟了新路径。(转化医学网360zhyx.com)
原文链接:
https://www.nature.com/articles/s41467-025-64296-z
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录








还没有人评论,赶快抢个沙发