基因编辑技术应用现状
| 导读 | “读取”阶段进入到后基因组时代,基因组的“改写”乃至“全新设计”正逐渐成为现实.在不断的探索研究中,基因编辑技术已经从... |
生命科学的迅速发展使得我们从生物遗传信息的“读取”阶段进入到后基因组时代,基因组的“改写”乃至“全新设计”正逐渐成为现实。在不断的探索研究中,基因编辑技术已经从最初依赖细胞自然发生的同源重组,发展到几乎可在任意位点进行的靶向切割,其操作的简易和高效极大地推动了物种遗传改造的发展。基因编辑可为合成生命的进一步改造提供手段,为新物种的创造提供更多的可能性。
基因编辑主要包括锌指核酸酶(ZFN) 技术、转录激活子样效应物核酸酶(TALEN) 技术、CRISPR-Cas核酸酶(CRISPR-Cas RNAs) 技术,它们都能特异性地识别靶位点,对其单链或双链进行精准切割后,并由细胞内源性的修复机制来完成对靶标基因的敲除和替换。由于CRISPR-Cas9系统构建相对容易且细胞毒性小,目前应用最为广泛。
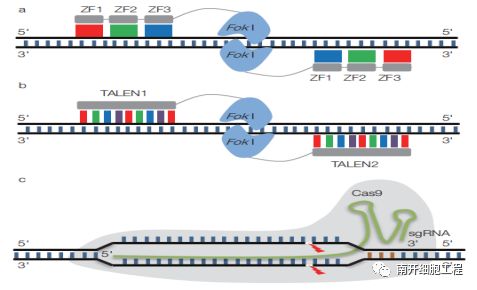
(a)锌指核酸酶(ZFN)基因编辑技术;(b)TALEN 基因编辑技术;
(c)CRISPR/Cas9 基因编辑技术
CRISPR/Cas系统应用
1 CRISPR/Cas9 技术
CRISPR/Cas 系统原本是细菌和古菌进化出来用于抵御外来病毒及质粒 DNA 的适应性免疫系统。II 型CRISPR/Cas9系统依赖于外源 DNA 片段在规律成簇的短间隔回文重复(CRISPR)位点整合,其经过转录及剪切后产生短的 CRISPR RNAs(crRNAs),crRNA 与反式转录的 crRNA(tracrRNA)退火结合,然后引导 Cas9蛋白介导序列特异性的外源 DNA 降解[1]。Jinek等[2]发现Cas9 发挥靶向切割作用所依赖的 crRNA 和 tracrRNA 可以融合为一体,作为 sgRNA。随后,若干研究组陆续报道 CRISPR/Cas9 系统可用于人类细胞的靶向基因编辑[3]。
2 CRISPR/Cas9-nickase 基因编辑技术
RISPR/Cas9系统使用的 crRNA 能容受一定程度的错配导致脱靶效应的产生,限制了 CRISPR/Cas9 系统在高精度编辑中的应用[4]。为了提高Cas9编辑系统的精度,研究者设计了“一个位点,双 sgRNA 靶向”的策略,即只对HNH或RuvC的其中一个位点进行沉默突变,形成和Cas9 nickase,这样就可以用两个不同的nickase对基因组进行锚定和单链剪切造成粘性末端。使用这种策略,可以大大降低CRISPR/Cas9 系统的脱靶效率。
3 CRISPR/dCas9-FoKI基因编辑技术
同样是为了解决 CRISPR/Cas9 技术的脱靶问题,Guilinger 等[5]采用了dCas9的策略,即对HNH和RuvC活性区域进行突变,使之无法行驶剪切功能而产生Dead Cas9(dCas9),dCas9只能依据sgRNA上的序列附着到特定的基因位点上,而不可以行驶剪切功能。为了实现 DNA 的切割,引入FoKI 核酸内切酶的切割结构域,与dCas9连接做成融合蛋白fCas9。在人类细胞的基因编辑中,fCas9 的特异性比野生型Cas9要高得多,同时也大大降低了脱靶效率。

(a) CRISPR/Cas9 技术 (b)CRISPR/Cas9-nickase 基因编辑技术
(c)CRISPR/dCas9-FoKI基因编辑技术
4 基于 CRISPR/dCas9 的单碱基编辑技术
(1) Liu课题组将源自大鼠的胞嘧啶脱氨酶(APOBEC1)与 dCas9 融合,从而使得胞嘧啶经脱氨基形成尿嘧啶,尿嘧啶在复制过程中被识别为胸腺嘧啶,实现C到T的转换,然后在后续的 DNA 复制或者修复作用下实现 C : G 碱基对到 T : A 的转变[6]。
(2)腺嘌呤经脱氨基形成次黄嘌呤,次黄嘌呤在复制过程中被识别为鸟嘌呤,从而可实现A到G的转换。Liu 课题组采用蛋白质进化工程手段对大肠杆菌的 tRNA 腺苷脱氨酶(TadA)进行改造,他们获得的第 7 代腺嘌呤碱基编辑器(adenine base editors,ABEs)能高效介导 A : T 碱基对到 G : C 转变[7]。
5 基于 CRISPR/dCas9 的基因表达调控技术
除了直接对 DNA 进行编辑,CRISPR/Cas 系统在基因表达调控上也可发挥作用[8]。例如,利用dCas9无核酸内切酶活性但仍能与DNA结合的特点,可直接阻碍其结合 DNA 与其他因子的结合,影响基因的表达。如果将转录抑制因子或者激活因子与dCas9融合,则可以实现靶基因的抑制与激活,为基因功能研究提供灵活的操作手段。
6 CRISPR/Cas12a 基因编辑技术
2015 年,张锋团队报道 V 型系统中的 Cpf1(CRISPR from Prevotella and Francisella 1)(现称“Cas12a”)是有功能的细菌免疫机制并能在人类细胞中介导有效的基因编辑[8]。CRISPR/Cas12a 需要的是富含 T 碱基的 PAM 序列,有助于其在基因组富含 A/T 碱基的物种中使用。陈佳课题组将无 DNA 切割活性的 dCas12a 与大鼠源的胞嘧啶脱氨酶(APOBEC1)融合,发现其与基于 Cas9 的碱基编辑器类似,能有效地催化人类细胞中 C 到 T 碱基的转换[9]。由于识别的是富含 T 碱基的 PAM 序列,基于 Cas12a 的碱基编辑系统能与基于 Cas9 的碱基编辑系统互补,为相关基础研究及将来的临床应用提供更全面的技术条件。
7 基于CRISPR/Cas 系统的RNA编辑技术
除了对 DNA 进行编辑,张锋课题组发现 CRISPR 蛋白家族的 C2c2(现称 Cas13a)可以靶向切割 RNA[10],随后他们证实 Cas13a 可在哺乳动物细胞中靶向降低 RNA 的水平[11]。利用 Cas13a 的 RNA 靶向功能,CRISPR/Cas13a系统被开发为 RNA 检测器用于疾病诊断[12]。张锋团队后续又发现了 Cas13b[13],其同样具有 RNA 靶向和编辑功能。另外,Cas13c 和 Cas13d 也具有类似功能[14]。RNA 编辑技术的建立,进一步拓展了 CRISPR/Cas 基因编辑技术的应用范围。
参考文献
[1] Nishimasu H, Ran F A, Hsu P D, et al. Crystal structure of Cas9 in complex with guide RNA and target DNA. Cell, 2014, 156(5): 935-949.
[2] Jinek M, Chylinski K, Fonfara I, et al. A programmable dualRNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 2012, 337(6096): 816-821.
[3] Chandrasegaran S, Carroll D. Origins of programmable nucleases for genome engineering. J Mol Biol, 2016, 428(5): 963-989.
[4] Ran F A, Hsu P D, Lin C Y, et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell, 2013, 154(6): 1380-1389.
[5] Guilinger J P, Thompson D B, Liu D R. Fusion of catalytically inactive Cas9 to FokI nuclease improves the specificity of genome modification. Nat Biotechnol, 2014, 32(6): 577-582.
[6] Komor A C, Kim Y B, Packer M S, et al. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature, 2016, 533(7603): 420-424.
[7] Gaudelli N M, Komor A C, Rees H A, et al. Programmable base editing of A•T to G•C in genomic DNA without DNA cleavage. Nature, 2017, 551(7681): 464-471.
[8] Qi L S, Larson M H, Gilbert L A, et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell, 2013, 152(5): 1173-1183.
[9] Zetsche B, Gootenberg J S, Abudayyeh O O, et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell, 2015, 163(3): 759-771.
[10] Li X, Wang Y, Liu Y, et al. Base editing with a Cpf1-cytidine deaminase fusion. Nat Biotechnol, 2018, 36(4): 324-327.
[11] Abudayyeh O O, Gootenberg J S, Konermann S, et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science, 2016, 353(6299), doi: 10.1126/science. aaf5573.
[12] Gootenberg J S, Abudayyeh O O, Lee J W, et al. Nucleic acid detection with CRISPR-Cas13a/C2c2. Science, 2017, 356(6336): 438-442.
[13] Smargon A A, Cox D B T, Pyzocha N K, et al. Cas13bis a Type VI-B CRISPR-associated RNA-guided RNase differentially regulated by accessory proteins Csx27 and Csx28. Mol Cell, 2017, 65(4): 618-630.
[14] Yan W X, Chong S R, Zhang H B, et al. Cas13d is a compact RNA-targeting Type VI CRISPR effector positively modulated by a WYL-domain-containing accessory protein. Mol Cell, 2018, 70(2): 327-339.
来源:高晨旭|图文
老师:陈德富
编辑:马子龙
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发