苏佳灿教授团队2023年论文合集:细胞外囊泡专题
| 导读 | 苏佳灿教授团改造益生菌Lactobacillus rhamnosus GG (LGG),构建了能够将内源性miRNA递送到骨微环境的骨靶向工程益生菌EVs(BT-LGG-EVs)用于OP治疗。 |
1.基于外泌体的骨靶向药物递送缓解炎症性肠病骨流失 (ESI高被引)

Guo J, Wang F, Hu Y, Luo Y, Wei Y, Xu K, Zhang H, Liu H, Bo L, Lv S, Sheng S, Zhuang X, Zhang T, Xu C, Chen X, Su J. Exosome-based bone-targeting drug delivery alleviates impaired osteoblastic bone formation and bone loss in inflammatory bowel diseases. Cell Rep Med. 2023 Jan 17;4(1):100881. doi: 10.1016/j.xcrm.2022.100881. Epub 2023 Jan 4. PMID: 36603578; PMCID: PMC9873828.
本研究表明基于外泌体的骨靶向药物递送可缓解炎症性肠病(IBD)中的成骨细胞骨形成受损和骨质流失。研究结果表明,在葡聚糖硫酸钠和吡罗西康IL-10敲除所致实验性IBD小鼠模型,骨量和骨质量明显下降。IBD小鼠表现出较低的骨形成率和较少的股骨成骨细胞。IBD小鼠骨髓间充质干/基质细胞(BMSCs)倾向于分化为脂肪细胞而不是成骨细胞。IBD患者血清促进人体骨髓间充质干细胞的脂肪生成。通过RNA测序显示,结肠炎下调了BMSCs中的Wnt信号。本文发现携带Wnt激动剂高尔基糖蛋白1的外泌体可以减轻IBD小鼠的骨量损失,促进骨形成,加速骨折愈合。这表明,通过骨靶向药物递送系统将BMSCs重新定向分化为成骨细胞,可以挽救在炎症微环境中的骨数量和质量损失。
2.骨靶向工程化益生菌外囊泡递送miRNA改善骨质疏松症

Han Liu, Yan Wu, Fuxiao Wang, Sicheng Wang, Ning Ji, Mingkai Wang, Guangyin Zhou, Ruina Han, Xinru Liu, Weizong Weng, Haoqi Tan, Yingying Jing, Wencai Zhang, Hao Zhang, Zhongmin Shi, Jiacan Su. Bone-targeted engineered bacterial extracellular vesicles delivering miRNA to treat osteoporosis. Composites Part B: Engineering 2023 Vol. 267 Pages 111047.
基于课题组前期提出的骨靶向生物材料与“三位一体”骨修复理念,苏佳灿教授团改造益生菌Lactobacillus rhamnosus GG (LGG),构建了能够将内源性miRNA递送到骨微环境的骨靶向工程益生菌EVs(BT-LGG-EVs)用于OP治疗。新型BT-LGG-EVs利用固有的成骨和破骨细胞抑制miRNA来增强治疗效果。BT-LGG-EVs表现出较强的体内骨靶向能力,无明显毒性。此外,BT-LGG-EVs在体外显著促进成骨并抑制破骨细胞形成。最后,BT-LGG-EVs显著改善绝经后骨质疏松小鼠的骨质流失。本研究为基于BEVs的新型肠骨轴提供了有力的证据,为益生菌或其功能性EVs在OP治疗中的应用奠定了坚实的基础。
3. 骨靶向工程化细菌外囊泡递送siRNA改善骨质疏松症

Han Liu, Hao Zhang, Sicheng Wang, Jin Cui, Weizong Weng, Xinru Liu, Hua Tang, Yan Hu, Xiaoqun L, Kun Zhang, Fengjin Zhou, Yingying Jing, Jiacan Su. Bone-targeted bioengineered bacterial extracellular vesicles delivering siRNA to ameliorate osteoporosis. Composites Part B: Engineering 2023 Vol. 255 Pages 110610.
基于课题组前期提出的骨靶向生物材料与“三位一体”骨修复理念,苏佳灿教授团队利用合成生物学手段改造益生菌Escherichia coli Nisle 1917(ECN),在BEVs膜表面展示骨靶向元件CXCR4,膜内部装载骨治疗元件SOST siRNA,定制同时具备骨靶向能力和骨治疗能力的工程化BEVs-hCXCR4-SOST siRNAs(BEVs-CSs)(图1)。定制的BEVs-CSs具有良好的骨靶向能力且无明显的体内毒性。BEVs-CSs可被骨髓间充质干细胞(BMSCs)内化,无明显的细胞毒性,且具有良好的促成骨分化能力。最终,BEVs-CS有效改善了OVX小鼠的骨质疏松症。总之,这种同时具备骨靶向与骨治疗能力的BEVs为OP治疗提供了一种创新、安全、高效和有前景的治疗方案。
4. 骨功能化外泌体工程化制备和持续递送用于原位骨再生

Sun J, Li G, Wu S, Yiming Zou, Weng W, Gai T, Chen X, Zhang K, Zhou F, Wang X, Su J. Engineering preparation and sustained delivery of bone functional exosomes-laden biodegradable hydrogel for in situ bone regeneration. Compos. B. Eng. 2023 July 15. doi: 10.1016/j.compositesb.2023.110803.
作为一种新兴的无细胞疗法,干细胞来源的外泌体已被广泛用于组织再生。然而,实现骨功能化外泌体的工程化提取及其在组织缺损中的持续递送仍然是一个巨大的挑战。基于此,本研究构建了一种新型骨形态发生蛋白 2 (BMP2) 过表达的工程化外泌体负载 GelMA 水凝胶用于原位骨再生。BMP2 过表达的外泌体是以小鼠胚胎成纤维细胞 (NIH-3T3)为工具细胞,通过基因操作和超速离心技术制备的。外泌体在颅骨缺损中的持续递送是通过可生物降解水凝胶实现的。总的来说,这项研究为治疗骨缺损修复提供了一种有前途的无细胞疗法。
5. 肠道类器官及类器官细胞外囊泡用于炎症性肠病的治疗

Han Liu, Jinru Sun, Mingkai Wang, Sicheng Wang, Jiacan Su, Can Xu. Intestinal organoids and organoids extracellular vesicles for inflammatory bowel disease treatment. Chemical Engineering Journal 2023 Vol. 465 Pages 142842.
炎症性肠病(IBD)以腹痛、腹泻和血便为特征,是一种慢性易复发的肠道炎症性疾病。IBD的病因和发病机制十分复杂,尚未完全明了。现有的IBD临床治疗效果也非常有限。因此,迫切需要寻找一种新的诊断和治疗方法。肠道类器官已广泛用于肠道疾病建模、药物开发和筛选、宿主-微生物相互作用以及肠道生物学和发育;而肠道类器官外囊泡(OEV)是一种很有前途的纳米载体,具有更接近天然组织的生理条件域组织结构,可以参与一系列生理和病理过程。因此,开发肠道类器官和肠道类器官细胞外囊泡在IBD治疗中具有重要意义。本文首先概述了IBD 的种类、特征和当前治疗方法。然后全面介绍了肠道类器官的传统和最新构建策略。随后总结了肠道类器官在IBD慢性并发症、黏膜损伤与修复、肠道微生态探索、IBD治疗等方面的应用。重要的是,我们首次使用OEV来表示类器官细胞外囊泡,并总结了OEV 的生物发生、结构、组成、内化和分离机制。与传统EVs相比,OEVs数量更多,生理效应更好,可用于治疗相关疾病,包括癌症、视网膜疾病和脑部疾病等。基于此,我们创新性地提出了一种使用 OEV治疗IBD的新策略。
6. 工程化细菌外囊泡用于中枢神经系统疾病的治疗

Ji N, Wang F, Wang M, Zhang W, Liu H, Su J. Engineered bacterial extracellular vesicles for central nervous system diseases. J Control Release. 2023 Dec;364:46-60. doi: 10.1016/j.jconrel.2023.10.027. Epub 2023 Oct 25. PMID: 37866404.
随着人口老龄化,中枢神经系统疾病的发病率呈上升趋势。各种屏障的存在,尤其是血脑屏障,给中枢神经系统的药物递送带来了挑战。越来越多的研究表明,肠道微生物群在中枢神经系统疾病中发挥着重要作用。肠道微生物群与中枢神经系统疾病之间的关系日益受到关注。越来越多的证据表明,肠道微生物群可以通过细菌外囊泡(BEVs)向宿主细胞输送生物活性物质,从而调节宿主信号通路,调节远处器官的功能。BEVs因其纳米结构、穿透血脑屏障的能力以及低毒性、高生物相容性、易于改造和大规模培养等特点,已成为治疗中枢神经系统疾病的一个前景广阔的平台。本文系统地总结了 BEVs 的生物发生、内化机制和工程改造方法,以及重点讨论了 BEVs 在治疗中枢神经系统疾病中的应用和潜在作用。最后,概述了 BEVs 在中枢神经系统疾病中应用的主要挑战和未来前景。通过对基于 BEVs 的新型肠脑轴的全面了解,为中枢神经系统疾病的治疗提供新的见解。
7. 植物细胞外囊泡与自身免疫性疾病

Han R, Wu Y, Han Y, Xiang L, Han L, Su J. Engineered plant extracellular vesicles for autoimmune diseases therapy. Nano Res. (2023). https://doi.org/10.1007/s12274-023-6112-1
自身免疫性疾病包括一系列以免疫系统失调为特征的疾病,导致B细胞和T细胞对人体自身健康组织的异常反应。植物细胞外囊泡是由磷脂双层包裹的纳米级颗粒,由植物细胞分泌,通过运输各种生物活性分子促进细胞间通讯。由于其纳米级结构、安全性、来源丰富、免疫原性低、产量高、生物相容性好、可有效靶向结肠和肝脏,被认为是治疗自身免疫性疾病的一个很有前景的平台。这篇综述系统介绍了植物细胞外囊泡的生物发生、理化和生物学特性、内化机制、分离方法及其在各种疾病中的应用,并特别关注其在自身免疫性疾病中的潜在作用,全面总结了植物细胞外囊泡的工程化方法和给药途径,展望了利用植物细胞外囊泡在自身免疫性疾病治疗中的优势和挑战。我们相信,通过对植物细胞外囊泡的全面了解将有助于开发出更多治疗自身免疫性疾病的创新策略。天然和工程化的植物细胞外囊泡无疑是治疗自身免疫性疾病新技术的宝贵资源,具有广阔的应用前景。
8. 骨靶向外泌体的构建策略和应用

Wang J, Li X, Wang S, Cui J, Ren X, Su J. Bone-Targeted Exosomes: Strategies and Applications. Adv Healthc Mater. 2023;12(18):e2203361. doi:10.1002/adhm.202203361. Epub 2023 Mar 17. PMID: 36881547.
随着全球人口老龄化,骨骼相关疾病成为威胁人类健康的重要社会问题。在这篇综述中,我们探讨了外泌体在骨靶向治疗中的应用及其对骨代谢过程的调节作用。特别地,通过关注于改良外泌体以提高其骨靶向能力,从而增强治疗效果并避免系统性副作用。最后我们还总结了当前骨靶向外泌体研究的进展和挑战,并对未来临床骨科应用的潜力进行了展望。
9. M2型巨噬细胞外泌体干预T2DM骨折愈合

Wang Y, Lin Q, Zhang H, Wang S, Cui J, Hu Y, Liu J, Li M, Zhang K, Zhou F, Jing Y, Geng Z, Su J. M2 macrophage-derived exosomes promote diabetic fracture healing by acting as an immunomodulator. Bioact Mater. 2023 Jun 1;28:273-283. doi: 10.1016/j.bioactmat.2023.05.018. PMID: 37303851; PMCID: PMC10247878.
2型糖尿病(T2DM)是一种常见的慢性代谢性疾病。T2DM会对患者自身其他组织的生长和修复造成影响,特别是对于骨组织。临床数据表明,在T2DM病理条件下,骨折愈合会发生延迟。外泌体是细胞分泌的一种细胞外囊泡,具有极低的免疫原性和较高的生物活性,广泛参与细胞之间的通讯交流。本文研究发现,由于骨免疫微环境的失衡,具体表现为M1型巨噬细胞的比例增加和M2型巨噬细胞的比例减少,从而导致T2DM小鼠骨折愈合明显延迟。M2外泌体可作为一种免疫调节剂,通过激活M1型巨噬细胞中PI3K/AKT信号通路促进其向M2型巨噬细胞极化,改善骨免疫微环境,进而加速T2DM骨折愈合。该研究揭示了M2外泌体促进M1型巨噬细胞极化的分子机制,为改善糖尿病骨折愈合提供了一个新的视角和潜在的治疗方法。
10. 理想的软骨类器官构建体系:DNA水凝胶载细胞外囊泡
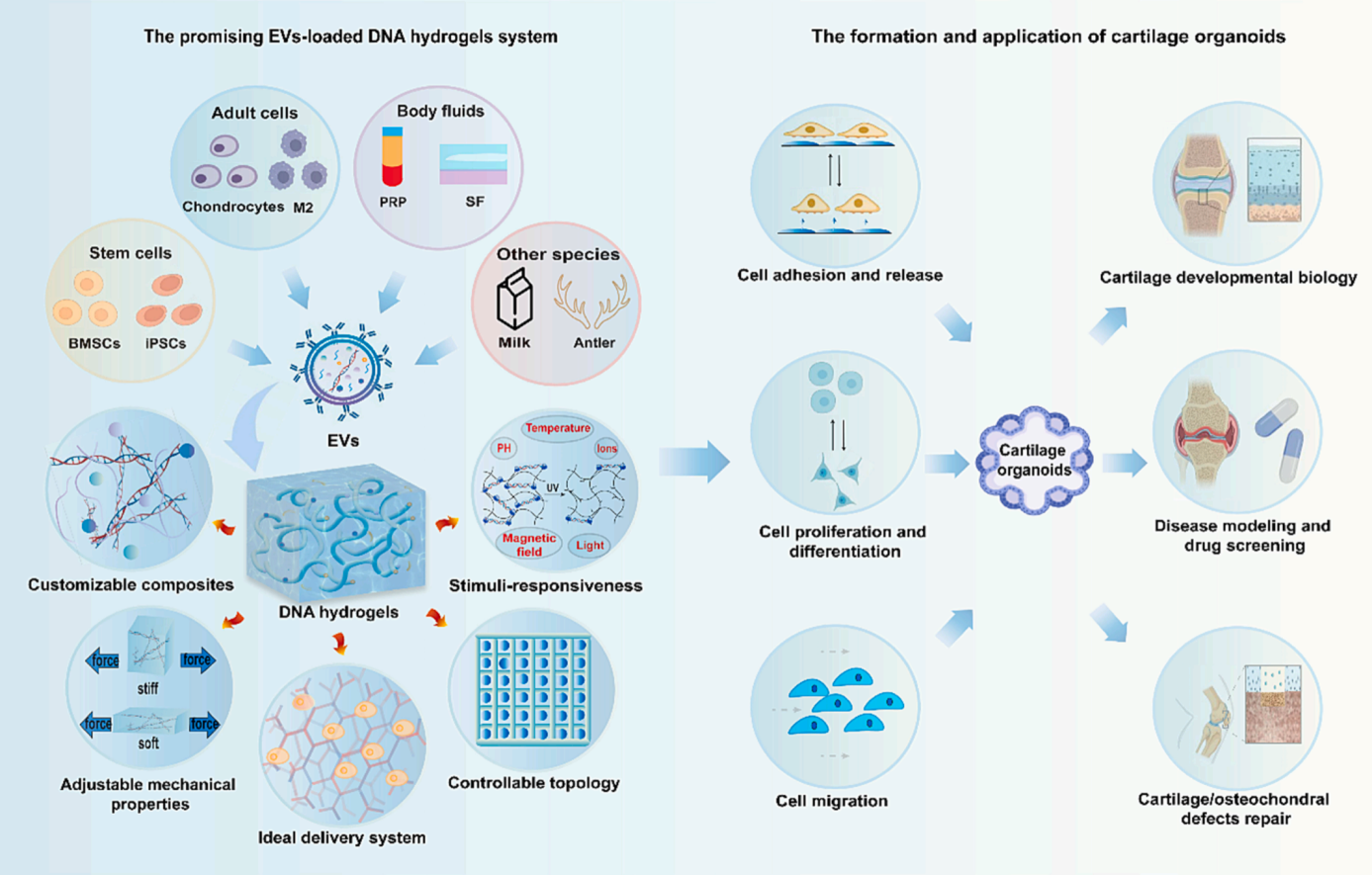
Ma Z, Wu Y, Li G, Liu J, Geng Z, Su J. Extracellular vesicles-loaded DNA hydrogels: A promising candidate for cartilage organoids engineering. Chemical Engineering Journal. 2023 Dec 1; 477; 147146. https://doi.org/10.1016/j.cej.2023.147146
骨关节炎等涉及关节软骨退变的疾病一直以来是严重威胁全球人类健康的公共卫生问题。近年来,体外培育软骨类器官(CORGs)逐渐成为软骨组织工程和再生医学的新范式,在研究软骨发育生物学、疾病病理学、药物筛选等方面潜力巨大。过去的几十年里,功能性生物材料如水凝胶作为人工细胞外基质被广泛应用于CORGs构建。其中DNA基水凝胶具有良好的生物相容性、生物降解性、智能可编程性以及高度的细胞亲和力,因此,被认为是一种优秀的候选材料。随着再生医学领域的飞速发展,基于细胞外囊泡(EVs)的无细胞疗法在治疗包括骨关节炎在内的一系列退行性疾病中展现出广阔的应用前景。本综述基于水凝胶与EVs调节细胞行为的生物学效应,创新性提出DNA水凝胶载EVs的CORGs培养体系并对其构建策略及应用场景进行展望,为CORGs在组织医学领域的应用提供了极富潜力的生物工程手段和研究方向。
 腾讯登录
腾讯登录

还没有人评论,赶快抢个沙发