首次!靶向“饥饿”癌细胞!港大最新研究:揭示癌症治疗新策略
| 导读 | 为了在营养匮乏的肿瘤微环境中生长,癌细胞通常会内化和降解细胞外蛋白以补充细胞内氨基酸。然而,既往研究报道的营养获取途径主要局限于自噬-溶酶体途径。目前尚不清楚其他蛋白质降解系统是否也有助于细胞外营养物质的利用。 |
11月20日,香港大学汪卫平团队在期刊《Advanced Science》上发表题为“Amino Acid-Starved Cancer Cells Utilize Macropinocytosis and Ubiquitin-Proteasome System for Nutrient Acquisition”的研究论文,研究证明,在氨基酸饥饿下,通过巨胞饮作用的细胞外蛋白质内化和通过泛素-蛋白酶体系统的蛋白质降解被激活为营养供应途径,使癌细胞对蛋白酶体抑制敏感。通过抑制巨胞饮作用和泛素-蛋白酶体系统,提出了一种加强癌症治疗氨基酸饥饿的创新方法。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202304791
研究背景
01
作为全球主要死亡原因之一,癌症的特点是细胞增殖不受控制,具有高度进展性。实体瘤通常超过其血液供应,并形成缺乏营养物质(如氨基酸和葡萄糖)的肿瘤微环境。作为体液中最丰富的有机成分,蛋白质有可能作为替代资源,因为每种蛋白质都可以提供数个数量级的大量氨基酸。因此,癌细胞会制定利用细胞外蛋白的策略。例如,在氨基酸饥饿下,细胞外蛋白通过巨胞饮作用内化。哺乳动物雷帕霉素靶标(mTOR)信号通路被抑制,mTOR 复合物 1(mTORC1)从溶酶体膜中释放,导致溶酶体上的液泡型H ATP酶(V-ATPase)组装。作为活性质子泵,这些V-ATP酶可降低溶酶体pH值,以增加蛋白酶活性并促进溶酶体降解蛋白质含量。 mTOR活性降低也会触发Unc51样激酶1/2激活,增强自噬体形成和自噬蛋白降解。然而,先前研究证明的营养获取途径主要局限于自噬-溶酶体系统。目前尚不清楚其他蛋白质降解途径是否也在细胞外蛋白质的利用中发挥重要作用。
研究进展
02
在这项研究中,除了传统的溶酶体途径进行细胞外蛋白质利用外,我们发现巨胞饮作用-UPS轴可以作为细胞外蛋白质内化和降解的另一种途径。研究显示,饥饿的癌细胞对UPS抑制变得更加敏感。因此,UPS可以作为癌症饥饿治疗的新靶点。我们的结果表明,蛋白酶体抑制增强了蛋白质内化作为反馈,这可能通过自噬降解提供补充营养。基于巨胞饮作用-UPS轴作为氨基酸补充途径,我们假设同时抑制巨胞饮作用和蛋白酶体可以显着加剧氨基酸饥饿。因此,我们探索了UPS抑制剂硼替佐米(BTZ)和巨胞饮抑制剂5-(N-乙基-n-异丙基)-阿米洛利(EIPA)联合治疗癌症的潜力。为了共同递送疏水性药物BTZ和亲水性药物EIPA,开发了一种pH响应性聚合物递送系统,以进一步增强药物在肿瘤组织中的积累并控制癌细胞中的药物释放。与之前消耗葡萄糖或阻断氨基酸转运蛋白的纳米药物形成鲜明对比的是,我们首次开发了一种靶向蛋白质分解代谢的配位纳米载体,作为基于饥饿的癌症治疗的有前途的策略(图1)。
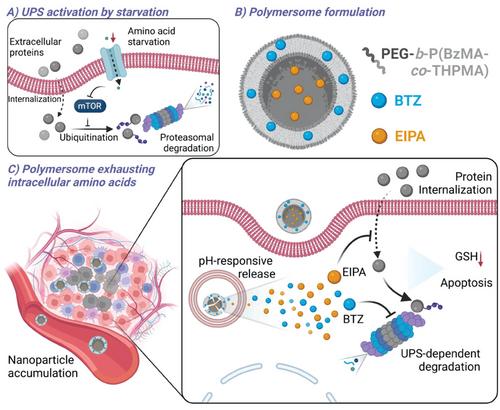
示意图。描绘了负载有 BTZ 和 EIPA 的 pH 响应性聚合物体耗尽细胞内氨基酸用于癌症饥饿治疗。
研究结论
03
综上所述,除了传统的溶酶体途径进行细胞外营养利用外,我们发现巨胞饮作用-UPS轴可以作为氨基酸供应的另一种细胞外蛋白质降解过程,以支持癌细胞存活。饥饿的癌细胞对BTZ表现出更高的敏感性。因此,我们将BTZ与巨胞饮抑制剂EIPA联合使用,以同时阻断蛋白质内化和UPS依赖性降解,通过避免代偿性蛋白质分解代谢来达到协同抗癌作用。为了促进该策略的临床转化,开发了一种pH响应性聚合物体来共同递送这两种药物,从而增强药物在肿瘤组织中的保留并提高治疗效果。通过靶向蛋白质分解代谢过程,这项研究为癌症饥饿治疗提供了新的见解。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202304791
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发