注意!这类检测在医疗机构开展需要三类证!
| 导读 | 目前,武汉友芝友医疗科技股份有限公司已有7个第三类注册证药物基因组学产品,是行业内获得药物基因组第三类医疗器械产品注册证最多的公司! |
过去三年,新冠疫情的席卷使得检验医学快速发展。而随着新冠疫情逐渐落幕,后疫情时代的到来,各地各级医疗机构实验室的工作重心逐步回归到临床诊疗上。那么如何发挥此前“巨资”建设的PCR实验室功能,减少PCR实验室设备空闲,成为了一项值得思考的事情。
药物基因组学指通过药物反应相关基因的检测,从而对用药的安全性和有效性进行评估。荧光定量PCR是开展药物基因组学检测的常用方法学之一,因此在后疫情时代积极开展药物基因组学检测能有效避免设备空闲、资源浪费的尴尬境遇。同时,国家相关部门也对基因检测的产品资质、实验室及操作人员都做出了系列法规规定,接下来就和小编一起看看应该如何安全合法地开展药物基因组检测项目吧!
医院开展药物基因组检测
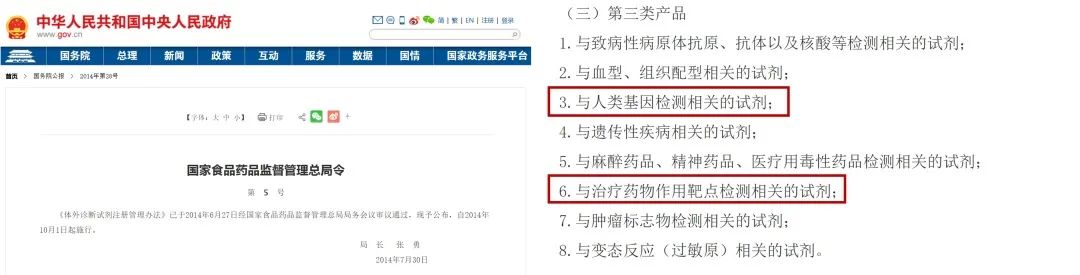
产品需具备NMPA批准的第三类注册证
国家食品药品监督管理总局局令第5号《体外诊断试剂注册管理办法》中提到:与人类基因检测相关的试剂属于第三类产品,需按第三类产品注册管理;与治疗药物作用靶点检测相关的试剂需按第三类产品注册管理。
基因检测需在正规PCR分子实验室开展
操作人员需具备PCR上岗证
卫生部办公厅关于印发《医疗机构临床基因扩增检验实验室管理办法》的通知中提到,第三章第十二条:“医疗机构经省级卫生行政部门临床基因扩增检验项目登记后,方可开展临床基因扩增检验工作。”第十四条:“医疗机构临床基因扩增检验实验室人员应当经省级以上卫生行政部门指定机构技术培训合格后,方可从事临床基因扩增检验工作。”

科研试剂
不得出具报告,不得向患者收取费用
卫生部办公厅关于印发《医疗机构临床基因扩增检验实验室管理办法》的通知,第一章总则第五条提到,“以科研为目的的基因扩增检验项目不得向临床出具检验报告,不得向患者收取任何费用。”

目前,武汉友芝友医疗科技股份有限公司已有7个第三类注册证药物基因组学产品,是行业内获得药物基因组第三类医疗器械产品注册证最多的公司!

同时,芝友医疗拥有独家双基因四位点检测的他汀产品(SLCO1B1 388A>G、521T>C;ApoE 388T>C、526C>T),SLCO1B1和ApoE基因与他汀安全性及有效性息息相关,其中就SLCO1B1基因多态性而言,388A>G、521T>C两个变异位点被广泛研究,主要证实了其与他汀类药物引起的肌病风险相关。基于SLCO1B1基因两个变异位点的检测将更能评估他汀肌病发生的风险,对人群进行风险等级划分。
2022年,芝友医疗高血压个体化用药相关“人类AGTR1、ACE、ADRB1、CYP2D6、CYP2C9基因检测试剂盒”获批第三类注册证,药物基因组产品线如虎添翼,同时为心脑血管疾病个体化用药提供更加全面的精准治疗方案!
此外,芝友医疗系列产品还具有以下特征:
① 操作便捷
② 开放试剂,可以兼容市面上常见荧光PCR仪
③ 判读简单,检测结果准确可靠
④ 特异性高,检测下限低至0.5 ng/μL
⑤ 防污染体系,采用dUTP-UNG酶系统,防止实验室气溶胶污染,避免假阳/阴性结果
阳春三月,中华医学会第十七次全国检验医学学术会议召开在即!!
芝友医疗将携自主研发的心血管药物基因组学产品、肿瘤靶向伴随诊断产品、循环肿瘤细胞CTC检测仪、全自动FISH玻片处理系统F900亮相本次盛会。届时将有新品推介会及丰厚礼品等候光临,欢迎各位医学专家和医疗从业者莅临芝友医疗展台B145参观、指导和交流,期待您的莅临。
会议时间:2023年3月30日~4月1日
会议地点:长沙国际会议中心(湖南省长沙市高铁会展新城国展路 118 号)
芝友展位:B145


 腾讯登录
腾讯登录




还没有人评论,赶快抢个沙发