
近年来,基于高通量测序的基因组拷贝数变异测序技术(Copy Number Variation sequencing,CNV-seq)可对染色体数目异常、大片段缺失/重复及致病性拷贝数变异进行检测,在产前诊断、辅助生殖、儿科遗传病辅助诊断等领域得到了广泛应用。
为助力临床精准诊断,博奥晶典在常规CNV-seq检测23对染色体非整倍体和>100Kb染色体拷贝数变异的基础上进行优化升级,同步推出检测试剂盒(RUO)和LDT检测服务。CNV-seq plus不仅能实现特定UPD检测、三倍体检测和母源污染鉴定,还能为临床提供本土化样本检测、数据解读和报告生成的一体化解决方案,进一步助力临床提高诊疗效率。
CNV-seq检测ROH的目的:筛查UPD
什么是ROH?
基因组纯合区域(regions of homozygosity, ROH)是指基因组区域中一定范围内连续呈现的杂合性丢失的现象。对于大部分的二倍体细胞如人类体细胞,拥有两份基因组,一份来自于父亲,另一份来自于母亲。在某一个等位基因位点上,如果来自父本和母本的碱基不同时,则该位点为杂合(heterozygous);如果因为某种机制(如远亲关系或近亲关系婚姻或基因转换)导致在一定范围内连续的等位基因序列都是纯合子而无杂合子(拷贝数仍为 2 个),则该区域为ROH。如检出多条染色体上均存在大片段 ROH 时需考虑父母亲缘关系(consanguinity);如果仅在一条染色体发现≥10Mb的ROH,应优先考虑单亲二体(uniparental disomy,UPD)的可能【1,2】。
什么是UPD?
UPD是指一个个体的两条同源染色体都来自同一亲本,或来自父母一方的染色体片段被另一方的同源部分取代。UPD的产生机制主要有三体细胞自救、单体细胞的自身复制(单体自救)等【3】。Nakka等【4】对440多万份样本研究后发现,UPD在活产儿中的发生率可达1/2000。当UPD出现在基因印记区域时,子代可能会遗传两个均有表达活性的等位基因,也可能遗传两个表达沉默的等位基因,从而导致基因剂量表达异常。
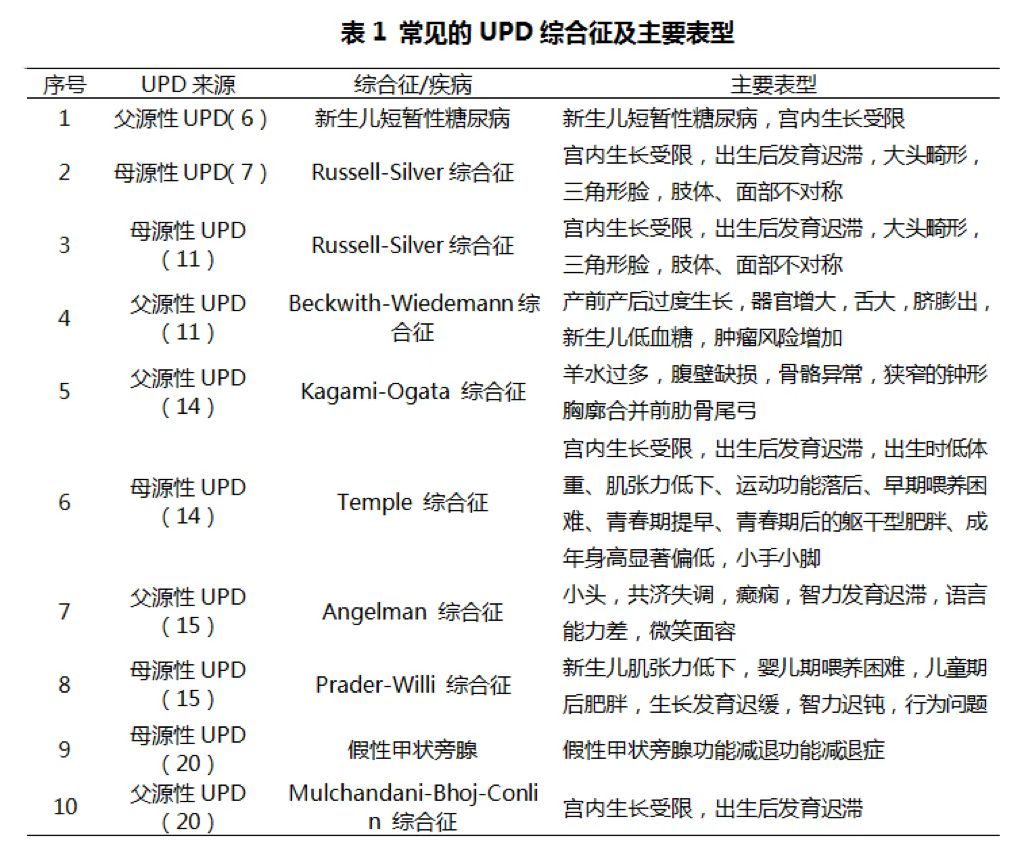
目前已知当第 6、7、11、14、15及20号染色体存在UPD时,可通过基因组印迹障碍导致疾病的发生【5】。常见的UPD综合征及主要表型详见表1,其中Angelman 综合征发病率约为1/20,000-1/12,000
【6】,临床表型包括小头,共济失调,癫痫,智力发育迟滞,语言能力差,微笑面容。
为什么要检测UPD?
大多数染色体UPD没有临床表型,当UPD发生在印记基因区域则会导致印记基因异常,出现异常的表型。目前针对上述UPD综合征(表1)尚无有效的治疗手段,因此,早发现、早诊断、早干预对于此类疾病的防控尤为重要。
产前筛查或诊断中如果发现涉及第 6、7、11、14、15及20号染色体的嵌合、NIPT筛查三体高风险或相关超声异常(如父源性14号染色体UPD的特殊钟形胸廓)或涉及14、15号染色体的罗伯逊易位、平衡易位等,应考虑进行UPD检测。2020年ACMG指南发布了关于UPD产前诊断的声明【7】,建议对如下人群在产前诊断时应检测UPD:孕妇高龄;采用PGT助孕,打算植入有印记染色体嵌合胚胎;穿刺绒毛或穿刺羊水提示印记染色体三体或单体嵌合;产前超声异常与某种UPD疾病表型一致;绒毛穿刺或羊水穿刺提示存在遗传的或新发的涉及14号或15号染色体的罗氏易位或者等臂染色体;新发的小标记染色体(sSMC),但不带有明显常染色质;发生在非罗氏易位的印迹染色体的3:1分离可能导致三体或单体挽救或配子补救。
UPD的检测方法
UPD的检测方法主要包括STR分型技术、SNP分型技术、甲基化PCR与甲基化MLPA 技术。其中最为经典的是STR分析,但通常不用于一线筛查,商业化的STR检测试剂盒仅检测特定的STR位点,难以覆盖常见的UPD综合征。基于SNP分型的UPD检测技术主要包括染色体微阵列分析技术(chromosomal microarray analysis, CMA)、全外显子组测序等方法,通过分析SNP位点的杂合性识别ROH,仅适用于单亲同二体型的UPD检测,检测灵敏性和分辨率与SNP探针的密度和分布有关。甲基化PCR和MLPA技术直接针对目标UPD综合征相关的关键印记基因的甲基化状态进行分析,对于病因的确诊有重要意义,通常用于UPD验证。
打破技术局限,博奥晶典自主研发基于CNV-seq测序数据的ROH检测系统
CNV-seq技术是基于低深度全基因组测序的新一代拷贝数变异检测方法,具有通量高、操作简便、兼容性高等优势,对于小的CNV以及低比例嵌合的CNV具有良好的检测效能,在临床得到了广泛的应用。但是,业内普遍认为CNV-seq技术仅适用于染色体拷贝数变异的检测,无法检测单亲二倍体UPD在内的ROH,这在一定程度上限制了CNV-seq在产前诊断中的应用。2019年4月发布的《低深度全基因组测序技术在产前诊断中的应用专家共识》【8】建议,临床高度怀疑胎儿为单亲二倍体时,应结合STR或 SNP array等技术进行检测。
目前临床应用的CNV-seq测序技术覆盖的SNP位点reads的平均深度1X左右,难以识别UPD和ROH。通过提高测序深度,或基于高深度测序法虽然可以解决UPD和ROH的检测问题,但测序成本会随着测序深度的增加而大幅增加。因此,如何使用低测序深度的数据满足ROH/UPD的检测需要,是一项极具挑战的工作。
针对上述难题,博奥晶典的研究科学家们开发了基于全基因组低深度测序CNV-seq的ROH检测技术,此项技术于2020年8月获发明专利授权(ZL202010896507.5)。本方法基于生物信息学分析方法的创新实现ROH的检测,在不增加测序深度、测序成本和实验操作的情况下,能支持深度低至0.1~0.2X的ROH检测。研究组基于临床CNV-seq 0.15~0.4X的测序深度数据开创性地提出SNP混合杂合度指标(SMHS)的计算方法,表明在极低测序深度下(低至0.2X覆盖深度),虽然每个SNP位点的基因型不可知,但是通过合并计算N个SNP杂合信息,计算SMHS得分可以检测多倍体和ROH。该算法打破了现有低平均测序深度数据不能用于判断ROH和多倍体的局限,这意味着不增加检测数据量的条件下就可以分析多倍体和ROH区域,不仅能显著降低检测成本还能缩短检测周期,给产前诊断工作和社会带来巨大效益。
图1 博奥晶典基于CNV-seq测序数据检测多倍体和基因组纯合区域ROH的系统专利技术
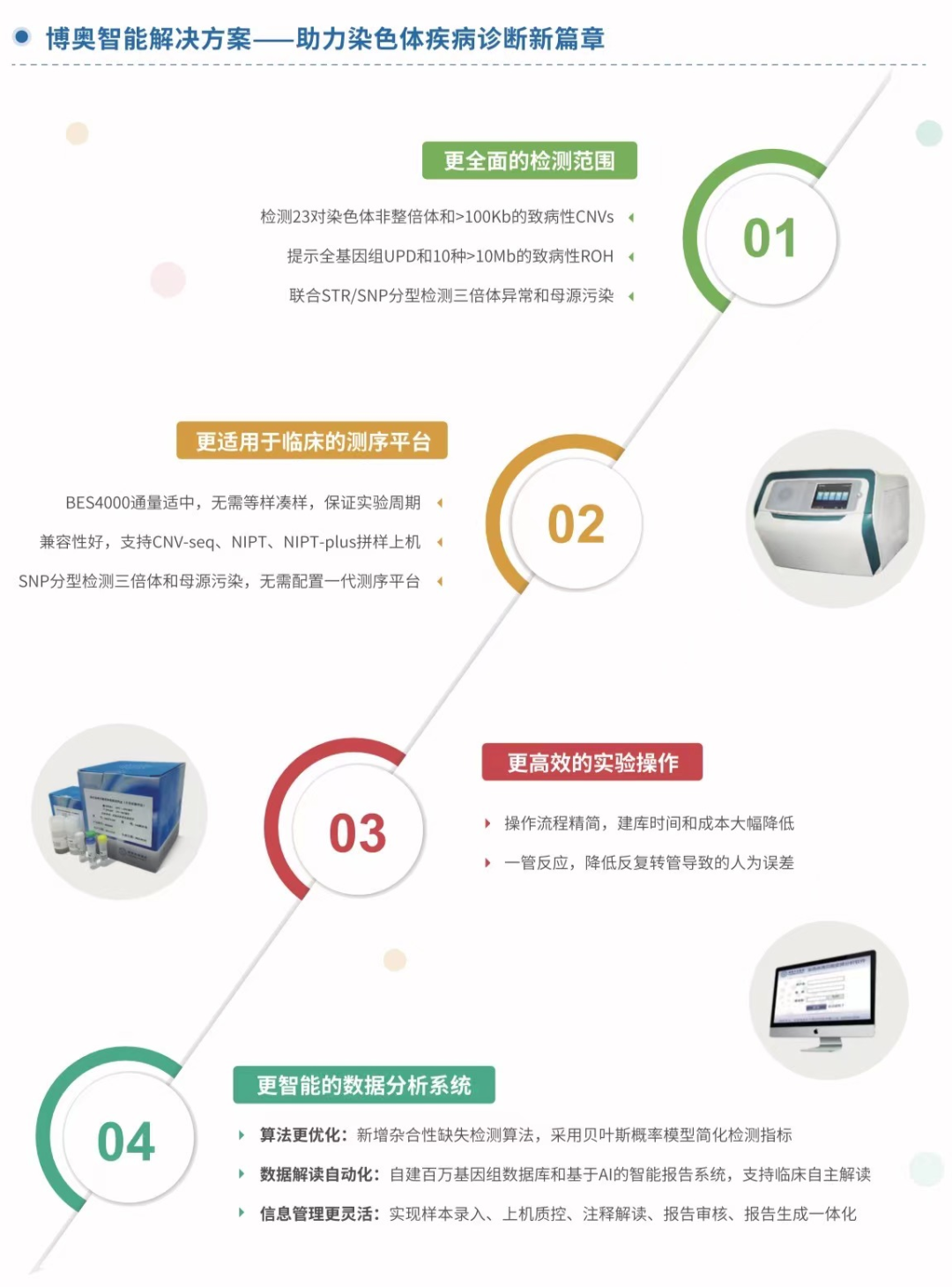
博奥晶典CNV-seq系列产品全面升级,在原有产品检测23对染色体非整倍体、100Kb以上缺失/重复的基础上,新开发了特有的生信算法并获得专利授权,新增基因组纯合区域ROH检测,可提示全基因组UPD和10种>10Mb的致病性ROH;此外,博奥晶典自主研发的基于BES4000的SNP分型技术有效提示三倍体异常和定量鉴定5%以上的样本交叉污染,为临床提供更具性价比的检测产品,为出生缺陷精准防控提供更全面的解决方案。
升级产品介绍
参考文献
[1] Armour CM , Dougan SD , Brock JA , et al. Practice guideline: joint CCMG-SOGC recommendations for the use of chromosomal microarray analysis for prenatal diagnosis and assessment of fetal loss in Canada[J]. Journal of Medical Genetics, 2018, 55(4): 215-221.
[2] Papenhausen P, Schwartz S, Risheg H, et al. UPD detection using homozygosity profiling with a SNP genotyping microarray[J]. Am J Med Genet A, 2011, 155A(4): 757-768.
[3] 刘维强, 孙路明, 沈亦平. 染色体三体、嵌合体及单亲二体的产前诊断和遗传咨询[J].中国产前诊断杂志(电子版),2020,12(02):1-5.
[4] Nakka P, Smith SP, O'Donnell-Luria AH, et al. Characterization of Prevalence and Health Consequences of Uniparental Disomy in Four Million Individuals from the General Population[J]. Am J Hum Genet, 2019, 105(5):921-932.
[5] Gaudio DD, Shinawi M, Astbury C, et al. Diagnostic testing for uniparental disomy: a points to consider statement from the American College of Medical Genetics and Genomics (ACMG)[J]. Genet Med, 2020, 22(7):1133-1141.
[6] Dagli A, Buiting K, Williams CA. Molecular and Clinical Aspects of Angelman Syndrome[J]. Mol Syndromol,201, 2(3-5): 100-112.
[7] Gaudio DD, Shinawi M, Astbury C, et al. Diagnostic testing for uniparental disomy: a points to consider statement from the American College of Medical Genetics and Genomics (ACMG)[J]. Genetics in Medicine, 2020, 22(7): 1133-1141.
[8] 中华医学会医学遗传学分会临床遗传学组, 中国医师协会医学遗传医师分会遗传病产前诊断专业委员会, 中华预防医学会出生缺陷预防与控制专业委员会遗传病防控学组. 低深度全基因组测序技术在产前诊断中的应用专家共识[J]. 中华医学遗传学杂志,2019; 36(4): 293-296.





 腾讯登录
腾讯登录




还没有人评论,赶快抢个沙发