【快讯】重磅!NMPA批准的国内首个微卫星不稳定(MSI)检测试剂盒花落桐树基因, MSI开启规范化有证时代!
| 导读 | 近日,常州桐树生物科技有限公司(桐树基因)自主研发生产的“微卫星不稳定(MSI)检测试剂盒(多重荧光PCR-毛细管电泳法)”通过国家药品监督管理局(NMPA)的审核 |
精准的肿瘤分子诊断,是提高肿瘤患者总体生存期的重要前提。其中,微卫星不稳定(MicroSatellite Instability,MSI)因其临床意义颇为广泛(包括辅助诊断林奇综合征、判断预后、预测辅助化疗疗效、预测实体瘤免疫治疗疗效),特别是MSI-H肿瘤特有的免疫敏感性备受业界关注。据统计,中国MSI-H肿瘤疾病负荷每年高达32.4万例,疾病负荷极高。但是,缺乏经过官方认证的标准化产品提供给临床肿瘤患者。
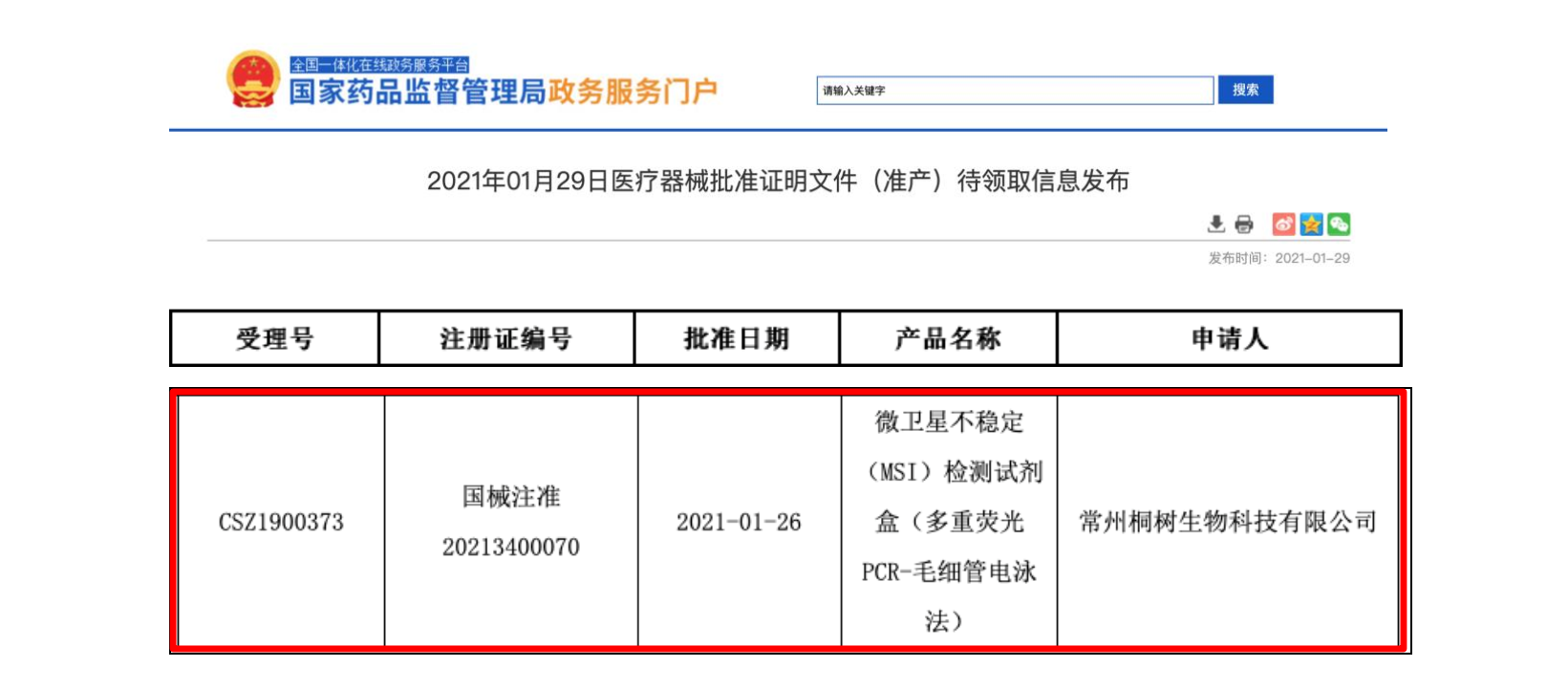
近日,常州桐树生物科技有限公司(桐树基因)自主研发生产的“微卫星不稳定(MSI)检测试剂盒(多重荧光PCR-毛细管电泳法)”通过国家药品监督管理局(NMPA)的审核,已于2021年1月26日获批用于体外定性检测结直肠癌患者肿瘤组织FFPE样本的“2B3D”(BAT-25、BAT-26、D5S346、D2S123、D17S250)微卫星位点状态,并取得国内首张微卫星不稳定检测III类医疗器械证书(国械注准20213400070)。
该试剂盒是中国首个基于“多重荧光PCR-毛细管电泳法”的MSI检测试剂盒,此次获批历经大量临床样本的严谨验证,通过注册生产质量体系的审查考核,NMPA经过严格审查终于颁出这意义深远的 “MSI第一张III类证”,也是国内肿瘤基因检测的一个“里程碑”!
桐树基因创始人严令华表示:
本次MSI试剂盒获批历时近5年,一路极其艰辛。幸得各级政府领导、各位行业专家和全体股东们的持续支持,使我们最终获得了NMPA的批准。此次获批上市不仅填补了国内微卫星不稳定规范化检测的空白,结束了MSI检测的“无证”时代。更为关键的是,终于有一个有证产品,造福全年30多万例MSI-H的肿瘤患者。同时,随着该试剂盒的获批,MSI检测将正式进入具有资质和检测能力的医院及第三方临检机构,毋庸置疑,这对于规范肿瘤行业MSI检测,助力临床医生制定诊疗方案,惠及更多肿瘤患者具有里程碑式的意义!
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发