同日两重磅!国产基因测序仪获NMPA批准上市、首个基于国产高通量测序仪的肿瘤基因检测试剂盒获批
| 导读 | 2019年8月29日,吉因加的Gene+Seq-200和Gene+Seq-2000基因测序仪双双通过国家药品监督管理局(NMPA)的批准上市。 |

2019年8月29日,吉因加的Gene+ Seq-200和Gene+ Seq-2000基因测序仪双双通过国家药品监督管理局(NMPA)的批准上市。

据悉,测序仪应用范围为:在临床上用于对来源于人体样本的脱氧核糖核酸(DNA)进行测序,以检测基因变化,这些基因变化可能导致存在疾病或易感性。该仪器在临床上仅限于与国家药品监督管理局批准的体外诊断试剂以及仪器配套随机软件配合使用,且不用于人类全基因组的测序或从头测序。
同日,国家药品监督管理局官网公示,深圳华大基因股份有限公司全资子公司华大生物科技(武汉)有限公司生产的 “EGFR/KRAS/ALK基因突变联合检测试剂盒(联合探针锚定聚合测序法)”,通过三类医疗器械产品的注册审批(注册证编号:国械注准20193400621)。
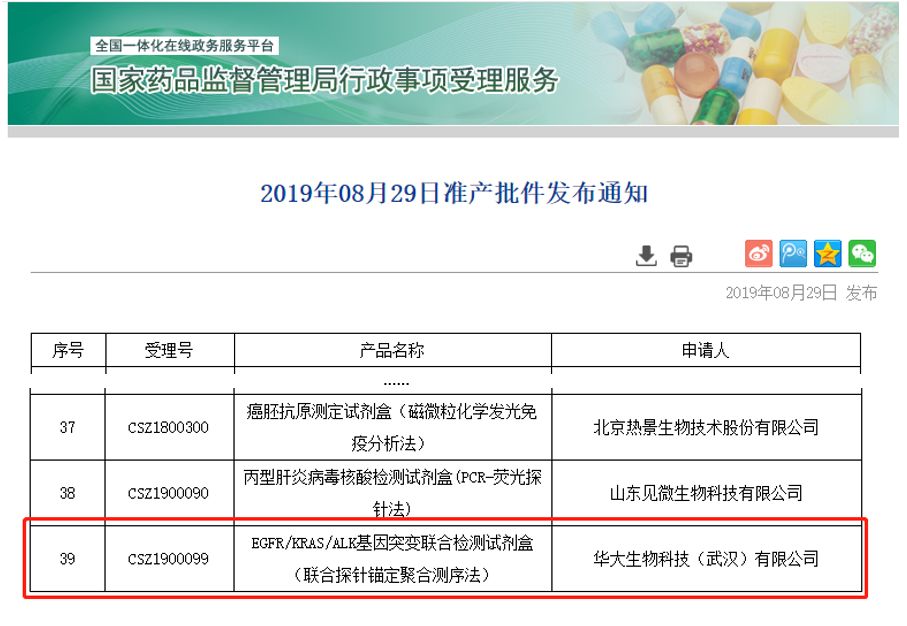
这是中国首个基于国产高通量测序仪的肿瘤基因检测试剂盒,彻底打破了进口测序仪在肿瘤基因检测试剂盒领域的垄断局面,意味着国产高通量测序仪以其核心技术和过硬质量在肿瘤临床领域实现重大突破。
该试剂盒用于定性检测非小细胞肺癌患者FFPE组织样本中EGFR/KRAS/ALK基因上发生的变异,可用于吉非替尼、盐酸埃克替尼、克唑替尼药物的非小细胞肺癌适应症的伴随诊断检测。
据悉,该试剂盒有三大特点:检测灵敏度国内领先、覆盖基因数多,检测范围大、配套自动化硬件、测序通量可灵活选择。其也是国内首个配备多测序平台的肿瘤高通量基因检测试剂盒,相比进口仪器,具有更高的灵活性,更能满足国内用户的多样化需求。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录

还没有人评论,赶快抢个沙发