两大院士牵头临床研究最新成果表明:5hmC在早期肝癌诊断中性能优秀!
| 导读 | 针对原发性肝癌,现今主要的治疗方案有手术切除、经导管动脉化疗栓塞、射频消融、靶向药物、肝移植、放射治疗及化疗等。复旦大学附属中山医院的樊嘉院士和国家肝癌科学中心/东方肝胆外科医院的王红阳院士与美国芝加哥大学何川教授和美国西北大学张玮教授合作,将外周血5hmC技术引入肝癌领域。两位院士牵头,共同发起了一项多中心肝癌早期5hmC标志物检测的临床研究,利用外周血5hmC信号变化,依托高通量基因组测序技术进行肝癌早期诊断。 |

我国作为肝癌高发国家,占全球肝癌发病率50%以上。目前,肝癌是我国第4位常见恶性肿瘤及第3位肿瘤致死病因。我国的肝癌患者具有其鲜明的特点,多具有肝炎和肝硬化背景。其中大约80%的肝癌与乙型肝炎病毒(HBV)慢性感染有关,这也与肿瘤的治疗方式选择和预后密切相关。
针对原发性肝癌,现今主要的治疗方案有手术切除、经导管动脉化疗栓塞、射频消融、靶向药物、肝移植、放射治疗及化疗等 。其中肝癌的外科治疗已经取得了较大的进步,术后5 年生存率也提高到30 %~40 %。但相对于其他消化道恶性肿瘤相比,肝癌的外科治疗效果尚不能令人满意,主要原因是肿瘤复发与转移。要解决此类问题,临床攻关方向上主要从两个方面着手: 早期诊断和选择个体化综合治疗方法。
复旦大学附属中山医院的樊嘉院士和国家肝癌科学中心/东方肝胆外科医院的王红阳院士与美国芝加哥大学何川教授和美国西北大学张玮教授合作,将外周血5hmC技术引入肝癌领域。两位院士牵头,共同发起了一项多中心肝癌早期5hmC标志物检测的临床研究,利用外周血5hmC信号变化,依托高通量基因组测序技术进行肝癌早期诊断。樊嘉院士和王红阳院士是中国肝癌研究的领军人物,多方强强联手,通过大样本的临床研究,将为中国肝癌早期诊断提供一个全新的技术方案、为临床积累极具价值的经验。
一、肝癌血液标志物的回顾
甲胎蛋白(AFP)
血清AFP检查方法可以回溯到1971年开始用于肝癌的筛查,是目前全世界应用最广泛的HCC肿瘤标志物,诊断HCC的敏感度为39%~65%,特异度为76%~94%。其敏感度和特异度在具有小肿块的HCC早期阶段,80%的患者血清AFP并未见明显升高,在肿块直径<3 cm和>3 cm的HCC患者中,AFP的检测敏感度分别为25%和52%。利用AFP进行肿瘤筛查,存在的主要问题是早期时阳性率较低。特别是我国约有30%肝部病人的AFP阴性,单独用AFP检查会遗漏这部分病人。所以,通常需要联合超声检查以提高敏感度。
甲胎蛋白异质体3(AFP-L3)
AFP-L3是AFP异质体的一种,为肝癌细胞特有,常用AFP-L3与AFP的百分比作为HCC早期诊断的标志物。AFP-L3在肝癌恶性程度评估、治疗效果和预后判定方面有着重要的临床价值和意义。
异常凝血酶原(DCP)
异常凝血酶原(DCP)是一种由维生素K缺乏所致的异常凝血酶原蛋白,在恶性肿瘤细胞中由于凝血酶原前体翻译后羧基化缺陷而产生。DCP在部分国家和地区例如被日本、韩国及印度,被批准作为HCC的有效标志物。
高尔基体蛋白73(GP73)
GP73在正常人的肝细胞中表达量极低或者不表达,而在肝癌患者血清中明显升高。有研究显示在低水平AFP小肝癌患者中,GP73检测敏感度和特异度分别为72.0%和94.0%,提示GP73是一个有价值的小肝癌的辅助诊断标志物,但还需要临床研究加以验证。
磷脂酰基醇蛋白聚糖3(GPC-3)
磷脂酰基醇蛋白聚糖3(GPC-3)是一种存在细胞膜表面的硫酸乙酰肝素糖蛋白,部分研究结果显示GPC-3的敏感度和特异度分别为36%~65%、65%~100%,且在小肝癌的检测方面敏感度优于AFP。
血清miRNA
外周血中miRNA 是一种高度保守的单链非编码小RNA,长度为20~25 个核苷酸,参与各种各样的调节途径,包括发育、细胞增殖和凋亡及肿瘤发生。大量研究表明miRNA 在肿瘤中起着促癌基因或抑癌基因的作用,并能同时调节多个靶基因,参与肿瘤的发生发展。近年来通过分析肝癌患者和正常人血清样本中表现出显著差异的miRNA,可筛选对肝癌患者诊断和预后有着潜在的指示作用的标志物。多项研究均显示多种miRNAs在肝癌诊断方面具有高特异度及敏感度,例如樊嘉院士团队历经9年攻关,从血浆中筛选到由7个miRNA组成的早期肝癌诊断分子标记物,可准确诊断肝癌,灵敏度和特异性均达80%以上。应用该试剂,进行血液检测同时配合影像学检查,还能显著提高对包括小于2厘米小肝癌在内的各种临床分型肝癌诊断效能,以此降低漏诊率和误诊率。血清miRNA 作为生物分子标志物已展现出良好的应用前景,不仅有助于肝癌的早期诊断和预后评价,也是一个肝癌早期无创检测的潜在标志物。
循环肿瘤细胞(CTCs)
循环肿瘤细胞(CTCs)是肿瘤原发灶或者转移性病灶脱落进入外周血液循环系统的肿瘤细胞。目前肝癌CTC研究还处于探索阶段,主要研究报道集中在肝癌的疗效评价和预后等方面。樊嘉院士团队的临床研究发现“循环干细胞样肝癌细胞”可作为肝癌切除术后复发预测新指标。团队自主研发多种CTC分选检测技术,并研制全球首台“全自动循环肿瘤细胞分选检测系统”原型机和检测试剂盒。该技术可实现“从全血标本→CTC”的一站式全自动样本处理(包括血液离心,液体处理,CTC捕获,细胞染色等步骤);捕获CTC灵敏度达90%以上,同时可用于下游单细胞测序分析,揭示每个CTC细胞的基因突变和表达谱,这将为临床实现肝癌早诊早治、有效预测复发、疗效监测以及干细胞研究建立良好平台。
二、表观遗传学技术在肝癌检测中的应用
基因DNA甲基化是目前研究较为深入的一种表观遗传学机制,DNA甲基化不涉及DNA序列的改变,往往要早于肿瘤发生的遗传学机制,所以在肿瘤的早期诊断上有着特殊的应用价值。2017年,加州大学张康教授利用甲基化技术对肝癌患者ctDNA进行了深入研究。通过分析715个肝癌患者ctDNA和560个正常样本的临床数据。该模型在训练组(AUC=0.966)中特异性为94.3%,灵敏度为85.7%;在验证组(AUC=0.944)中特异性可达90.5%,灵敏度达到83.2%。
三、肝癌早诊中5hmC标志物的临床研究
研究概述
本研究是一项多中心临床试验,在中山医院、东方肝胆医院等同步进行。利用5hmC检测技术5hmC-Seal捕获外周血cfDNA中的5hmC序列,测量分析5hmC水平,并对5hmC修饰水平进行标准化处理后,利用生物信息学工具,在前肝癌组和正常人组之间寻找有显著修饰水平差异5hmC基因位点。随后利用回归模型对如上所得到的差异位点进一步筛选、优化,从而得到一组具有高度灵敏度和特异性的5hmC生物标记物。进一步,所得的生物标记在独立样品中进行验证。
试验设计
本研究共入组了2554例受试者,其中肝癌患者1204例,慢性乙肝患者或肝硬化392例,健康对照958例。收集受试者血浆,分离cfDNA。利用5hmC-Seal技术进行5hmC捕获,然后通过NGS进行测序分析。其中,训练组1120例样本,早期肝癌组335例,慢性乙肝患者或肝硬化263例,对照522例。通过早期肝癌vs健康对照组,早期肝癌vs慢性乙肝患者或肝硬化组,筛选5hmC表达特征量,用于建模。应用建立的模型对验证组进行性能验证,在验证组队列1(1194例)中有早期肝癌220例、慢性乙肝患者或肝硬化史患者167例、晚期肝癌442例、肝癌未分期147例、慢性乙肝患者或肝硬化129例、健康对照256例;在验证组队列2(240例)中有早期肝癌24例、晚期肝癌13例、肝癌未分期23例、健康对照180例。
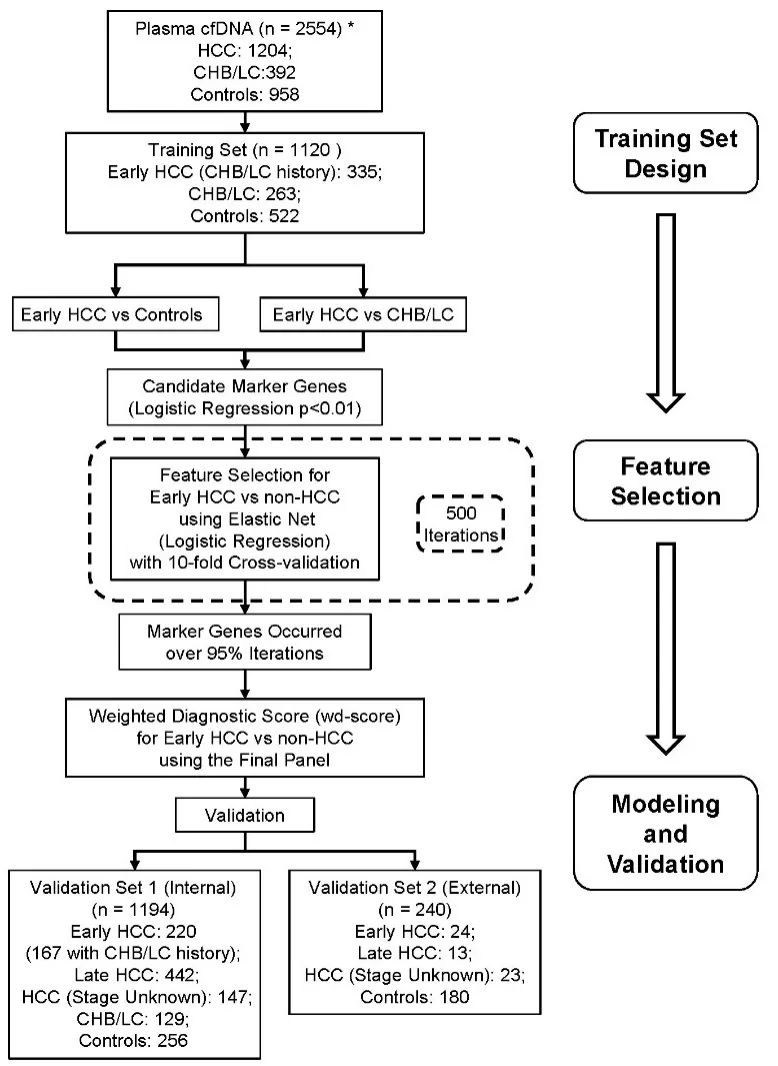
图1 研究方案路线图
四、研究结果分析
5hmC信号特征分析
5hmC-Seal数据显示同一组来源的样本具有很高的相关性,表明技术可靠性,以及各组不同来源的临床样本之间5hmC信号具备可比性(Pearsons’ r > 0.99图2A)。通过随机50例肝癌和50例健康组样本分析,5hmC谱显示5hmC富集区域主要位于转录起始(TSS)和转录末端(TES)之间的区域(图2B)。
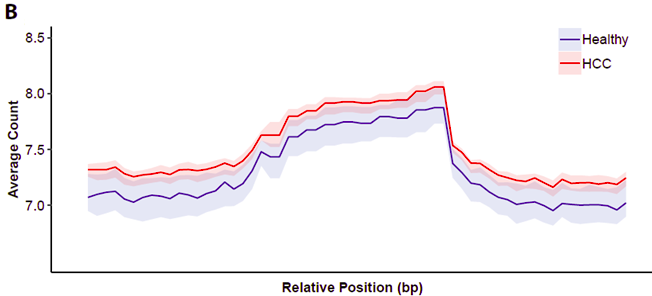
图2 5hmC测序图谱分布
模型构建及诊断表现
研究者首先在训练组中选取了917个候选标志基因,这些基因在肝癌组与健康对照组以及肝癌组与慢性乙肝患者或肝硬化史患者中显示显著的5hmC差异修饰水平。利用弹性网络正则化方法及逻辑回归建模方法筛选32个标志物的组合(图3A-B)。根据对32个标志物进行权重诊断评分,可区分早期肝癌和非肝癌组,也可以区分早期肝癌和健康对照组(图3C-D)。5hmC模型预测性能明显优于AFP,在训练组和验证组1中区分早期肝癌和非肝癌人的曲线下面积(AUC)为71.4-81.4%(图3C-D)。更为重要的是5hmC模型可以区分出AFP(cutoff值=20ng/mL)误判为阴性的人群,例如训练组中160例早期肝癌患者被AFP误判,而5hmC模型可达到92.4%的AUC。
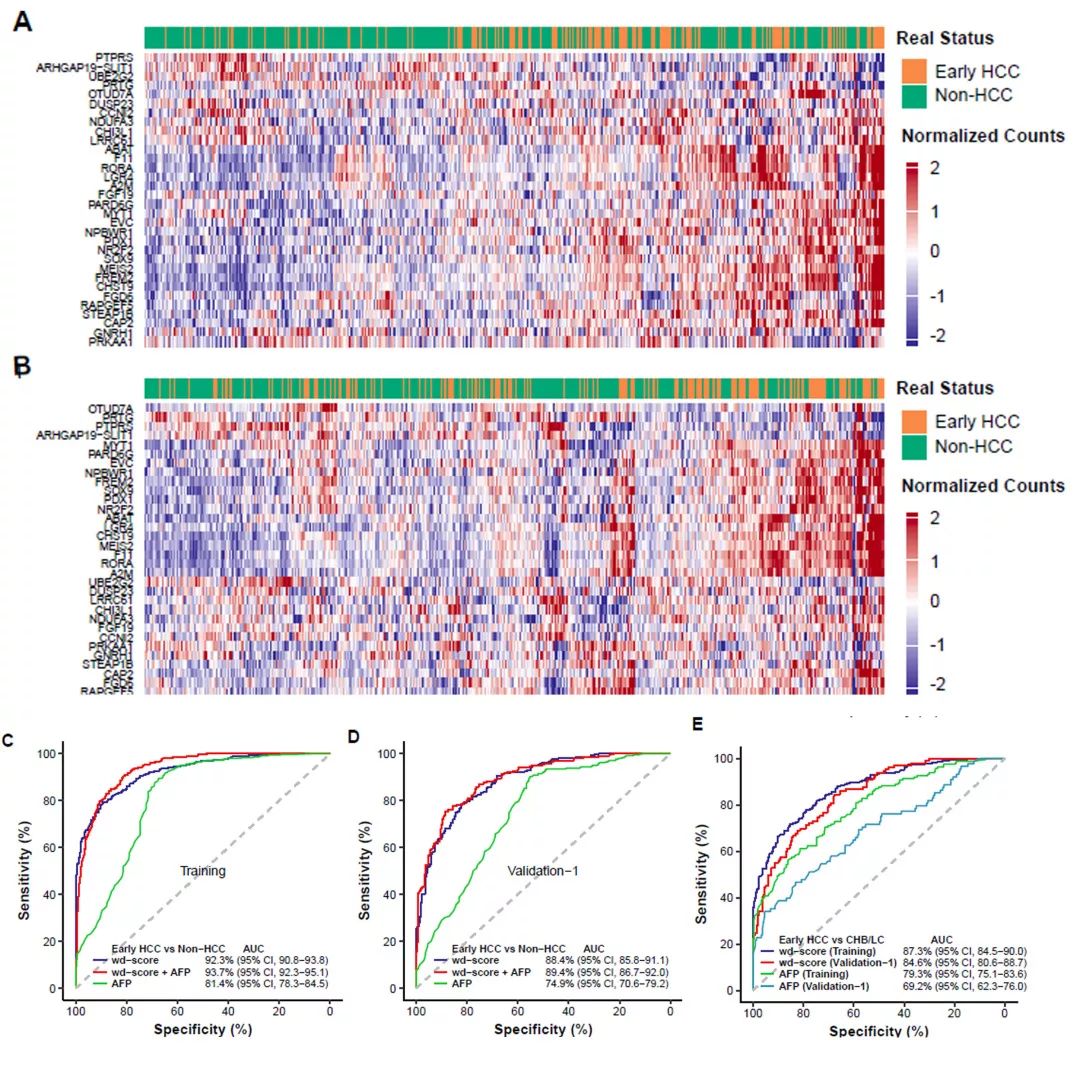
图3 5hmC位点筛选和诊断模型构建
此外,将5hmC标志物结合AFP可进一步提高AUC的表现(图3C-D)。早期肝癌与慢性乙肝患者或肝硬化患者的鉴别诊断是目前最具挑战的临床诊断难题。在训练组和验证组1中,5hmC表现要优于AFP,5hmC的AUC可分别达到87.3%和84.6%(图3E)。该诊断模型可准确区分早期肝癌和慢性乙肝患者或肝硬化患者。
5hmC标志物跟临床分期相关且具有备肝组织特异性
通过训练组和验证组分析,5hmC判别评分在肝癌组中高于健康对照组,而早期肝癌评分也显著高于慢性乙肝患者或肝硬化患者(图4)。判别评分随着巴塞罗那临床肝癌BCLC分期升高而增加。5hmC模型显示出了在鉴别0期患者和非肝癌人群中出色的区分能力,在训练组中AUC可达90.4%,在验证组中AUC可达87.1%。值得注意的是,5hmC评分可区分小肿瘤肝癌患者(≤2.0cm)和非肝癌患者,AUC可达85.1%。
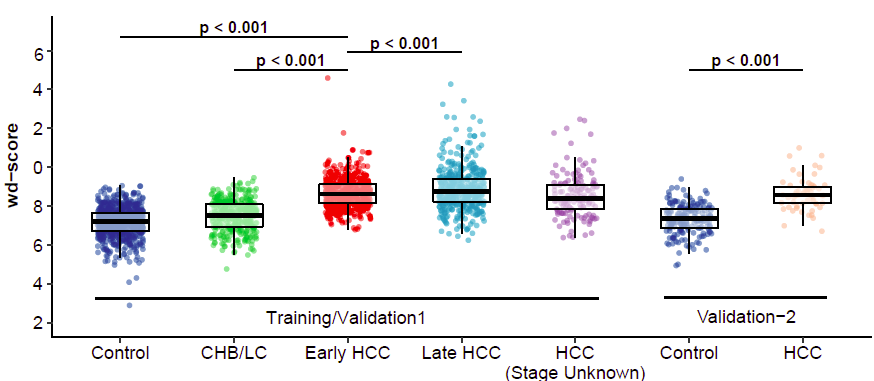
图4 不同组别的5hmC模型评分分布
诊断模型标志物靶基因的生物学
主要的诊断标志物靶基因5hmC谱显著与肝来源H3K4me1 或H3K27ac峰区域、预测的增强子的5hmC谱相关。图5显示在一个随机选择肝癌患者和健康组代表性数据中以2个基因ESRRG和SOX9为例,结果提示5hmC-Seal片段读数和数据库Roadmap Epigenomics Project、Encyclopedia of DNA Elements Project (ENCODE) 中H3K4me1 或H3K27ac峰重叠。917个候选基因在KEGG注释中主要涉及代谢过程(如碳、氨基酸),例如“乙醛酸盐和二羧酸盐代谢”、“甘氨酸、丝氨酸和苏氨酸代谢“,以及肝功能如“胆汁分泌”,“补体和凝血级联”。这些途径中的许多候选基因与肝癌、乙型肝炎病毒感染或纤维化的生理发病机制有关,例如“补体和凝血级联”中的A2M、KNG1、酪氨酸和苯丙氨酸代谢中的ALDH3A1。
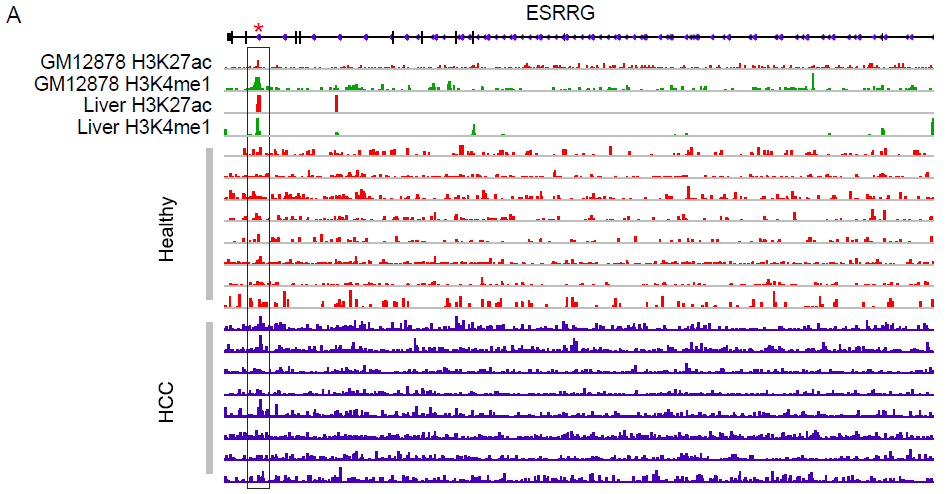
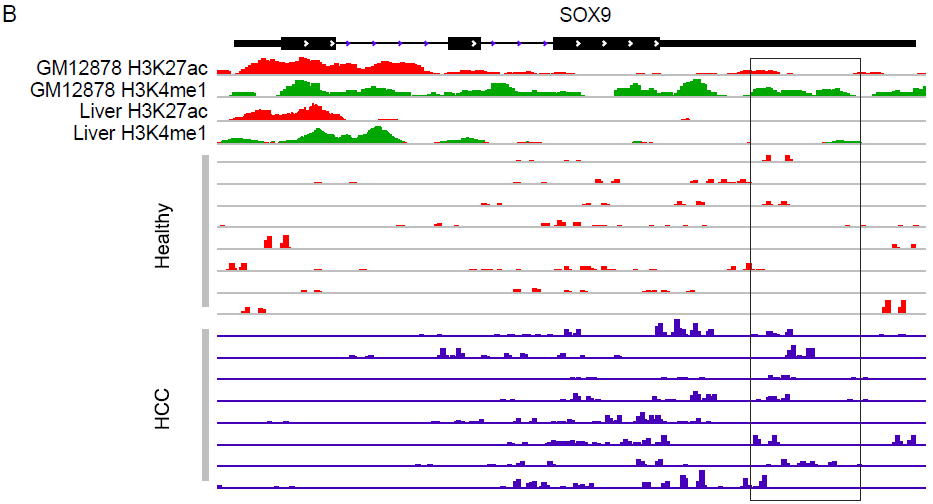
图5 候选基因之ESRRG和SOX9的5hmC分布
此外,利用肿瘤基因组图谱(TCGA)基因数据,对cfDNA中5hmC标志物的基因表达相关性进行了探索。在早期肝癌与健康对照组之间5hmC差异修饰排名靠前的基因同样在TCGA中排名靠前的差异表达基因中富集,提示患者来源cfDNA中5hmC标记物与基因表达相关。
五、5hmC在早期肝癌诊断中性能优秀,为临床应用奠定坚实基础
本研究中大样本(2554例)的临床研究显示,5hmC模型不仅准确区分早期肝癌患者和健康对照人群,同时还可区分早期肝癌患者和慢性乙肝患者或肝硬化患者。此外,该5hmC诊断模型具有肝癌组织特异性特征。功能分析显示了5hmC作为标志物的潜在背景机制,也促进了对肝癌发病机制的理解。相信未来更多的包括回顾性研究和前瞻性的临床研究,将进一步验证5hmC模型的性能,并最终建立无创5hmC肝癌临床诊断模型。高度敏感的5hmC检测技术在早期肝癌研究中的发现为开发泛癌种、无创血液诊断和筛查工具奠定了坚实的基础。
研究者介绍
樊 嘉 院士

樊嘉,中国科学院院士,复旦大学附属中山医院院长、上海市肝病研究所所长、复旦大学肝癌研究所常委副所长。现任中国医师协会外科分会肝脏外科医师委员会主任委员、FACS等。曾任抗癌协会肝癌专业委员会主任委员、中华医学会肿瘤学分会主任委员等。长期致力于肝肿瘤外科临床诊疗、基础研究及教学工作。首创肝癌门静脉癌栓多模式综合治疗技术,使伴门静脉癌栓的晚期肝癌由不可治变为部分可治。曾获教育部自然科学奖一等奖、国家科技进步二等奖、 “2016年谈家桢奖”、“2016年何梁何利奖”、“吴阶平-保罗杨森医学药学奖”等诸多奖项。
王红阳 院士

王红阳,中国工程院院士,现任国家肝癌科学中心主任,东方肝胆外科研究所副所长,东方肝胆外科医院综合治疗二科主任,兼任国家自然科学基金委医学部主任、国家“863”计划和现代化医学技术领域专家。曾获曾获国家科学技术进步奖(创新团队奖)、国家自然科学二等奖、何梁何利基金科技和技术进步奖等诸多奖项。长期从事肿瘤信号转导的基础与临床研究,对肿瘤医学研究有重要建树。
何 川 教授

何川,美国芝加哥大学化学系终身教授、John T. Wilson讲席教授、芝加哥大学生物物理动力学研究院主任、芝加哥大学癌症研究中心会员、美国霍华德休斯医学研究所(HHMI)研究员、北京大学长江讲座教授,开设合成与功能分子生物中心,并任主任;参与筹建北京大学未来基因诊断高精尖创新中心;迄今已经发表300篇SCI学术论文,在国际顶尖期刊(Nature、Science、Cell)正刊发表研究文章超过20篇。2017年2月22日,《Nature》 News大篇幅介绍何川教授利用化学标记方法重新发现了DNA和RNA的表观遗传功能以及该领域的发展过程,充分肯定何川教授在表观遗传学研究中的开拓性贡献。
张 玮 教授

张玮,美国西北大学芬伯格医学院预防医学系、Lurie癌症研究中心、以及遗传医学中心教授,并兼任伊利诺伊大学医学院药理系教授。生物信息学及大数据分析专家,长期从事癌症生物标志物、人类遗传学、癌症药物基因组学的研究工作,发表SCI论文140余篇,专著3部,论文被引用超过5000次。曾获美国癌症研究学会Merck Co.学者奖,多种学术期刊编委和审稿人,以及美国NIH/NCI癌症分析技术专项基金的评审委员。
5hmC背景介绍
5-甲基胞嘧啶(5mC)是DNA胞嘧啶环中第五碳通过脱氧核苷酸甲基转移酶(DNMT)甲基化所形成,在哺乳动物胚胎发育以及疾病发生发展中起着重要的作用。5mC经过Ten–eleven translocation(TET)的氧化作用形成5hmC,研究显示羟甲基化在正常基因组中表达量相对稳定,表明羟甲基化有独特的表观修饰作用,不仅仅是5mC代谢的中间产物。5hmC与包括癌症在内的多种疾病相关,在多种肿瘤组织中低水平的5hmC得到证实。5hmC水平的高低与肿瘤的类型及临床分期也有着密切的关系,如肺癌中,随着病理分期发展,5hmC的水平进行性下降。肠癌、胃癌和食管癌的临床研究也显示出来5hmC能够准确区分癌症患者和健康对照人群,在胃癌的临床数据中可以看到灵敏度和特异性可同时达到90%以上,具有较高的临床应用价值。基于化学捕获的5hmC检测技术是一种新的液体活检技术,利用高通量测序并比对分析的方法可获得更为精确的5hmC的基因图谱。利用该技术,有望克服目前液体活检CTC、ctDNA敏感性和特异性不够高的缺陷,使得肝癌早诊成为现实。
复旦大学附属中山医院蔡加彬博士,张歆昱博士和东方肝胆外科医院陈磊研究员,美国西北大学张舟博士为该文章共同第一作者。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发