Cell:陈列平团队重大突破!新型免疫抑制通路被发现!
| 导读 | 前有荣获诺奖的PD-1与PD-L1免疫抑制通路,后又前几天刚刚报道的NKG-2A免疫抑制信号的发现。今天著名的华人科学家陈列平团队又发现了一条全新的免疫抑制通路。这些通路在肿瘤逃逸中均起到令免疫系统“刹车”的作用。现有的发现,可以从免疫检查位点的不同方面启动免疫抑制。 |
前有荣获诺奖的PD-1与PD-L1免疫抑制通路,后又前几天刚刚报道的NKG-2A免疫抑制信号的发现。今天著名的华人科学家陈列平团队又发现了一条全新的免疫抑制通路。这些通路在肿瘤逃逸中均起到令免疫系统“刹车”的作用。现有的发现,可以从免疫检查位点的不同方面启动免疫抑制。今天,我们来看看,陈教授是如何发现LAG-3以及该通路重要的临床意义,该研究的最新进展发表于12月21日的《Cell》杂志。

免疫检查位点的作用机制我们讨论了许多次了,其核心机制包括“警察”、“叛乱分子”和“免死金牌”。人体自身存在免疫“警察”—T细胞,而“叛乱分子”指人体中的肿瘤细胞,“免死金牌”这里统指免疫检查位点,到目前为止包括James P.Allison和Tasuku Honjo教授发现的PD-1与PD-L1、Eric Vivier教授团队发现的NKG-2A以及此次陈列平教授发现的LAG-3。PD-1与此次发现的LAG-3主要存在于T细胞,而前几天刚发现NKG-2A则存在于T细胞和NK细胞。这三种分子在整个肿瘤免疫领域均起到“免疫刹车”作用。
此次最核心的主角之一—LAG-3其实最早发现于2003年,当时的研究人员发现这种名为淋巴细胞活化基因3(LAG-3)其作为受体具有很强的免疫抑制总用,当信号被激活时主要负责负性调控CD4和CD8+T细胞的增殖、活化及其免疫功能的发挥。虽然这一分子的主要作用早已被明确,但其配体一直存在着较大的争议,也就是说,究竟是谁猛踩了“免疫刹车”,我们不得而知。
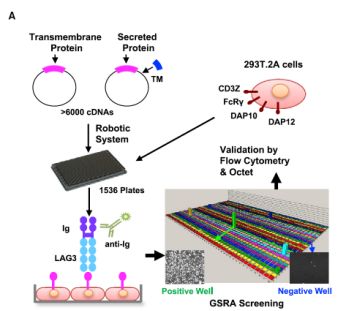
为了分析出LAG-3准确的配体,陈列平教授首先开发了一种名为Genome-scale receptor array(GSRA)的技术,用以筛选LAG-3的配体。这套GSRA技术的基本原理通俗点讲就是给众多分泌蛋白加上个“锚”。因为分泌蛋白种类繁多、数量巨大,不便于筛查。GSRA是给这些分泌蛋白加上跨膜结构域,令这些分泌蛋白牢牢地锚定在细胞表面,在利用抗原—抗体结合的原理使LAG-3去识别其特异性的配体。
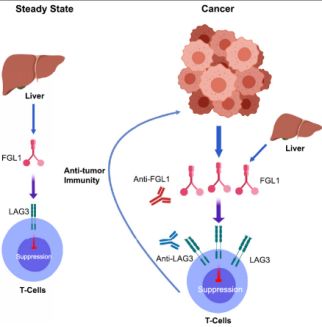
通过这一技术平台,陈教授团队筛选出一种名为FGL1的分子,它能够于LAG-3紧密结合,随后研究人员证实了FGL1与LAG-3结合可以启动免疫抑制作用。
但问题是FGL1主要表达在肝脏和胰腺内,这和肿瘤又有什么关系呢?
研究人员随后对肿瘤数据库进行了生物信息学的统计分析,他们发现包括肺癌、乳腺癌、结肠癌等实体肿瘤FGL1的表达均被上调,这就可以一定程度的解释FGL1与LAG-3结合启动肿瘤免疫抑制的说法。
既然FGL1与LAG-3及其PD-1与PD-L1都可启动肿瘤免疫抑制,那么他们之间又有什么关系呢?研究人员发现FGL1与LAG-3的作用完全独立于PD-1与PD-L1,通过对PD-1受体阻断患者的分析发现,当FGL1表达水平高时,患者的预后往往更差,因此,同时阻断这两条通路或许更有利于肿瘤的治疗。
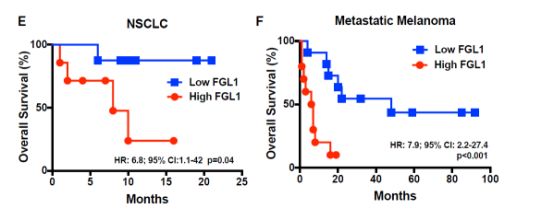
这一猜想已被小鼠实验证实,而最终的结果还是要通过人体实验来验证,我们期待陈教授接下来的人体实验。此次研究的亮点不仅是其利用的GSRA技术,更为重要的是明确了LAG-3的配体FGL1分子,其未来的抗肿瘤应用前景巨大!
参考文献:
Kurt Schalper, Lieping Chen. Fibrinogen-like Protein 1 Is a Major Immune Inhibitory Ligand of LAG-3
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发