中国首个肿瘤NGS基因检测试剂盒获CFDA批准上市
| 导读 | 7月23日,国家食品药品监督管理总局(CFDA)发布了《2018年07月23日准产批件发布通知》国内首个获得CFDA批准的NGS肿瘤多基因检测试剂盒。由广州燃石医学检验所有限公司申请的“人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)”获得准产批件。燃石医学 较早布局IVD试剂产品立足医疗行 |
7月23日,国家食品药品监督管理总局(CFDA)发布了《2018年07月23日准产批件发布通知》国内首个获得CFDA批准的NGS肿瘤多基因检测试剂盒。由广州燃石医学检验所有限公司申请的“人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)”获得准产批件。
燃石医学
较早布局IVD试剂产品立足医疗行业的燃石医学成立于2014年3月。2016年下半年,获红杉资本、济峰资本、招银国际、联想之星B轮融资3亿元;2015年获济峰资本、红杉资本、联想之星A+轮融资1.5亿元;2014年获北极光创投、联想之星A轮融资4000万元。
CEO汉雨生,曾任BioTek Instrument中国区总经理、北极光创投投资经理;COO揣少坤,拥有生物信息学与转化医学领域13年的资历;CMO刘颢,曾于诺华、辉瑞主持新药研发。
主要产品或服务在于:1.根据癌种、基因型等提供30余种基因检测服务,如520基因大Panel检测、遗传性肿瘤易感基因检测、肺癌相关168基因检测、肠癌、淋巴瘤等专业基因检测等。
旗下IVD产品人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(杂交捕获测序法),于2016年获得CFDA创新医疗器械特别审批通道并于今天7月23日,获得准产批件。
截至目前,累计服务患者超过7万例,早筛研发样本1000例;在《Annals of Oncology》等学术期刊与合作医院、医生联合发表近30篇SCI文章,平均影响因子约6.4,其中近一半影响因子大于10;与医院、医生合作的科研项目达180个。
下一代测序(NGS)技术
下一代测序(NGS)技术是一项颠覆性的生物技术,它产生了海量的基因序列数据,需要依赖仔细的翻译和解析转化成与临床相关且可操作的信息,相比其他IVD行业最火爆的几类技术而言,NGS发展最为迅速,大有后来居上的势头!
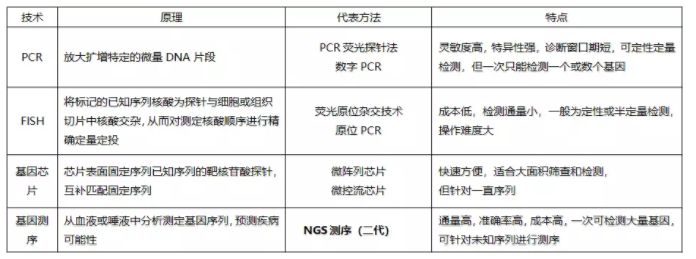
分子诊断的核心在于基因,手段大致分为四类:PCR,FISH,基因芯片,基因测序。
几类技术中,NGS发展最为迅速,相比其他技术大有后来居上的势头,这其中有两个重要的原因:一是随着生物技术的发展,人们越来越认识到,很多疾病,特别是基因突变导致的疾病,很难由单一或数个基因来确定,想要理清病理,着眼全局很有必要,“全基因、多组学”的概念开始盛行。二是人们意识到,早发现,早治疗是对付很多疑难杂症的最佳办法,因此早筛在未来有很大的潜在市场。而NGS技术恰好能够为这两个需求提供很好的技术支撑。
NGS测序技术的不断革新和迭代,近两年来,由于政策的扶持力度加大,国内科研机构和企业着手开发具有自主知识产权的国产测序仪,积极布局精准医学。完成上游核心技术的突破,进而摆脱对上游仪器及试剂的依赖,突破增长瓶颈。
随着更多靶向药物的上市对检测技术提出更高要求,及医生对检测产品质量的识别能力提升,鉴于今年下半年和明年,CFDA将陆续批准部分NGS肿瘤基因检测试剂盒产品上市,预计未来,NGS会在农业、精准医学等领域,实现突破性进展。NGS市场也将形成不同梯队不同细分领域的竞争态势。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发