新闻联播重磅直播 | 国内首个PD-1抑制剂获批上市,优先审评的时间能够缩短到四到六个月批准上市
| 导读 | 2018年6月15日,国家药品监督管理局正式批准PD—1抗体纳武利尤单抗注射液在中国上市,针对的适应症是经过标准化疗治疗失败的晚期非小细胞肺癌患者。专家指出,这种新药的上市将为晚期非小细胞肺癌患者的治疗带来新的治疗手段和希望。 |
2018年6月15日,国家药品监督管理局正式批准PD—1抗体纳武利尤单抗注射液在中国上市,针对的适应症是经过标准化疗治疗失败的晚期非小细胞肺癌患者。专家指出,这种新药的上市将为晚期非小细胞肺癌患者的治疗带来新的治疗手段和希望。
新闻稿件全部文字内容如下:
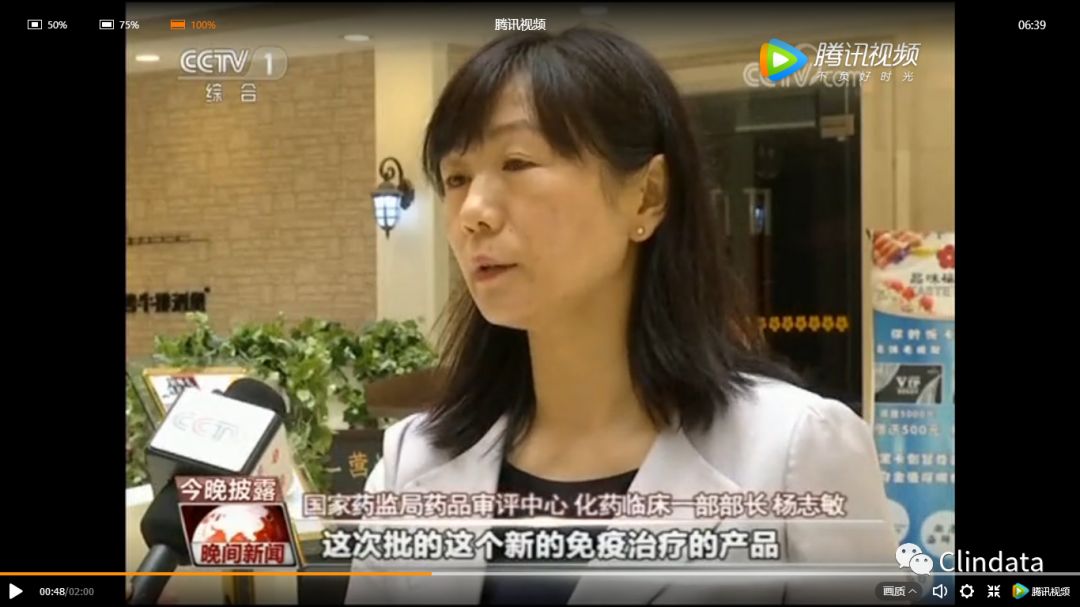
肺癌是排全球死亡第一位的疾病,据世界卫生组织统计,每年有超过170万人因肺癌死亡,在中国,肺癌是发病率最高的癌症,其中,非小细胞肺癌是最常见的类型,约占所有肺癌患者中85%,国家药监局药品审评中心 化药临床部一部部长杨志敏说:“”这次批的这个新的免疫治疗产品,它和传统的化疗,和小分子靶向治疗,从作用机理来说完全不同,在中国的研究也证明了,它对这些晚期非小细胞(肺癌)患者,死亡风险可以显著下降,下降32%(的死亡风险)。“
2014年7月,全球第一款PD-1抑制剂在日本上市,用于治疗晚期恶性黑色素瘤,临床研究发现,部分经过治疗后缓解的病人达到了长期生存,因此,PD-1抑制剂就受到了全世界的广泛关注,此后,美国、欧盟、澳洲、香港等地,都紧跟着完成了PD-1抑制剂上市。
2016年,美国科学杂志将这种癌症免疫治疗评选为“年度最大科学突破”。因为它不仅彻底打破了传统的癌症治疗方式,而且还带来了横跨多个癌症的突破性进展,部分晚期患者实现了长期生存,国家药监局表示,目前同类的国产新药也正在研发,有的已进入审评阶段。
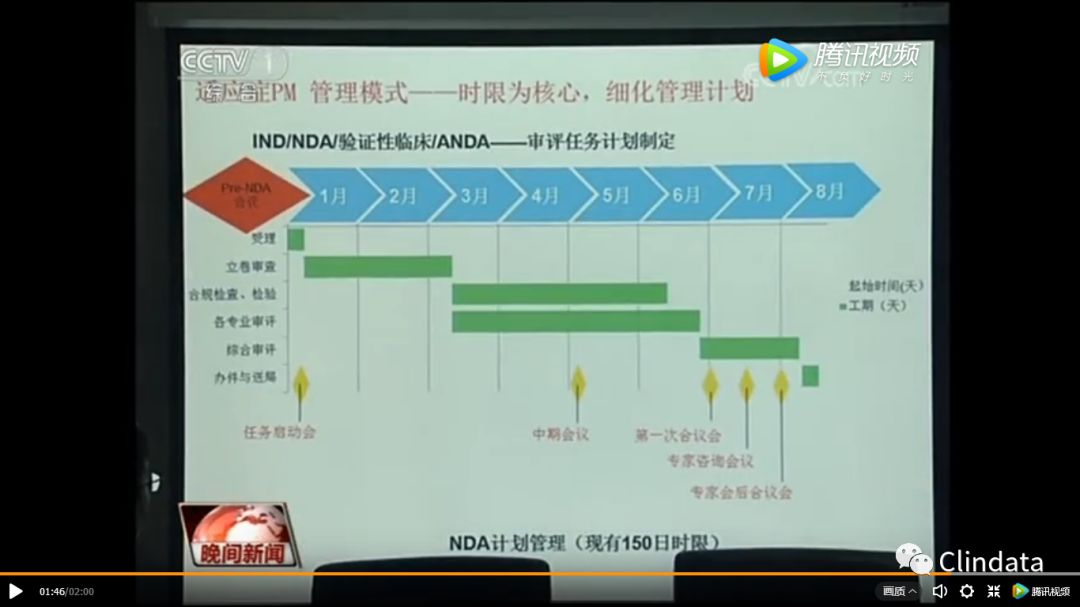
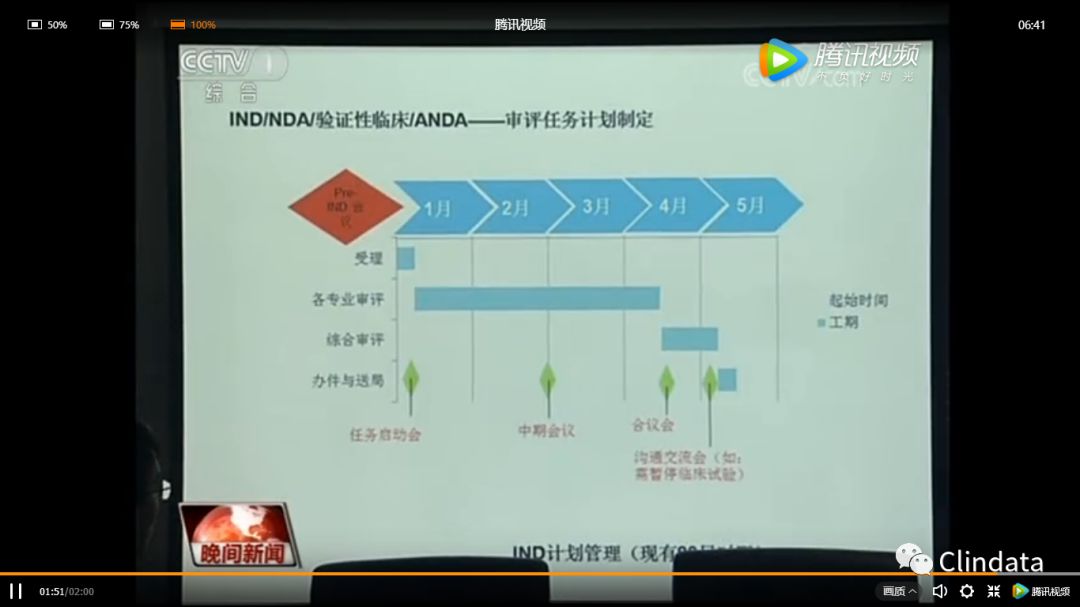
杨志敏部长说:“从目前来看,我们未来的希望优先审评的时间能够缩短到四到六个月批准上市。“
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发