Nature发文,股价大跌!p53究竟如何影响CRISPR的未来?
| 导读 | Nature Medicine在本周一上线了两篇CRISPR的相关文章 ,发现CRISPR-Cas9系统能够诱导细胞内p53介导的DNA损伤反应,影响CRISPR的基因组编辑。 |

Nature Medicine在本周一上线了两篇CRISPR的相关文章 [1-2],这两篇文章中的研究均发现CRISPR-Cas9系统能够诱导细胞内p53介导的DNA损伤反应,影响CRISPR的基因组编辑。
文章上线之后CRISPR相关公司的股价大跌,CRISPR Therapeutics一度下跌接近13%,Editas Medicine下跌接近8%,Intellia Therapeutics下跌接近10%,Sangamo Therapeutics下跌接近5%。
投资者的反应之所以如此强烈,主要是由于很多人担心经过CRISPR编辑的细胞其癌变的风险会提高。但事实果真如此吗?我们先看一下这两篇文章的研究内容。
文章解读
这两篇文章的研究人员分别来自卡罗林斯卡研究所 (Karolinska Institute)以及诺华。诺华和卡罗林斯卡的研究人员分别使用了不同种类的细胞,卡罗林斯卡的实验室使用的是一种视网膜色素上皮细胞 (RPE1)。他们在实验中使用的RPE1并不属于转化细胞,只是其端粒酶逆转录酶能够稳定表达,从而抑制端粒酶活性,使其永生化。该类细胞来源于人的视网膜色素上皮细胞,与治疗视网膜退行性疾病等CRISPR相关疗法的研发具有比较高的相关性。
卡罗林斯卡实验室的发现也算是意外,他们在使用CRISPR–Cas9系统对多种类型的细胞系进行dropout screens实验的时候发现,在RPE1细胞中靶向重要基因的guide序列并没有被有效的清除。
但他们同时也发现靶向TP53基因(能够编码p53)的guide浓度显著提升。作者认为这种现象可能是由于Cas9引发的双链DNA断裂(DSB)能够活化p53,从而导致细胞生长抑制。
该实验室也通过一系列实验证实了以上推论:如果在p53功能正常的细胞中使用Cas9对基因组进行编辑的话,就能够引发DNA损伤反应,导致细胞周期停滞。
但从文章中我们也可以看出这一现象依赖DSB的存在,如果使用不具备剪切功能的CRISPR系统对基因组进行编辑也就有可能不会产生这一现象。
该研究也发现如果抑制DNA损伤反应的话就能够提高CRISPR在正常的非转化细胞中的精准编辑效率,但这种操作同时也会使损伤的基因组逃过胞内的DNA损伤检测系统。
相比卡罗林斯卡的文章,诺华的文章关注度更高(或者说话题性更高?) 。诺华在该项研究中使用的是人多能干细胞。由于这类细胞能够分化形成几乎任何类型的细胞,因此其也有可能被应用于很多类型疾病的治疗。
但以前的很多研究发现相比其他类型的细胞而言,人多能干细胞中的基因靶向效率要低很多。因此诺华的团队希望能够提高CRISPR在多能干细胞中的基因编辑效率。
诺华的团队通过All in one inducible Cas9 + doxycycline的体系将多能干细胞中的编辑(Indels)效率提高到了80%。但他们同时也发现经过基因编辑之后只有很小一部分细胞能够存活。而且更加不幸的是,他们最后发现之所以CRISPR能够成功编辑这些细胞,是因为这些细胞的p53功能存在缺失,才使得基因组编辑能够顺利进行。
其实这也很容易理解,因为多能干细胞与早期胚胎内的细胞非常类似,对于DSB的极端敏感能够从某种程度上抑制胚胎中异常细胞的进一步增殖,这也是一种自我保护机制。
这两篇文章中p53所扮演的功能有一些不同,在卡罗林斯卡的文章中,DNA的双链断裂能够活化p53,导致细胞周期停滞。但在诺华的文章中p53的影响要严重的多,因为他们发现能够成功进行编辑的细胞很多都是存在p53功能缺陷的细胞,而不存在p53缺陷的细胞却没有正常的存活。
换句话说,该实验中使用的CRISPR-Cas9系统能够将那些存在p53功能缺陷的细胞筛选出来,由于p53是抑癌基因,所以将这些存在p53功能缺陷的细胞应用于疾病治疗的话就有可能导致肿瘤的形成。
影响有多大?
我觉得这两项研究所能产生的影响其实并没有多数投资者想象中的那么大。因为即使p53会影响CRISPR-Cas9系统在某些类型细胞中的基因组编辑,也并不意味着所有的CRISPR疗法都存在这种问题。
首先,至少从目前来看不存在双链DNA断裂的基因组编辑中不会存在这个问题。比如上个月张锋、David Liu以及J Keith Joung联合成立的Beam Therapeutics就很难受影响。因为这家公司在使用CRISPR对碱基进行编辑,并不涉及DNA的剪切和断裂。
而且除了碱基编辑,使用NHEJ机制的CRISPR-Cas9系统也可能不会受影响。用于疾病治疗的CRISPR疗法主要通过两种方式对DNA序列进行编辑,一种是利用非同源末端连接(NHEJ)机制形成indel,这样可以破坏原有基因的功能,这也是治疗镰状细胞贫血的策略。这种策略也叫做基因破坏 (gene disruption)。除了这种机制,还能够通过同源介导的修复(HDR)来引入其他基因,这种策略叫做基因修复 (gene correction)。
卡罗林斯卡那篇文章的第一作者EmmaHaapaniemi在接受 STAT News 采访时说在他们实验中基于NHEJ修复机制的CRISPR-Cas9,即使在p53功能被活化的情况下也依然能够正常进行基因组编辑。
因此CRISPR Therapeutics,Editas Medicine这些公司pipeline里基于NHEJ机制的研发项目可能并不会受p53的影响。但对于一些HDR相关的研究项目却有可能会受到这些研究的影响。至于影响有多大还需要进行后续的研究才能知晓。
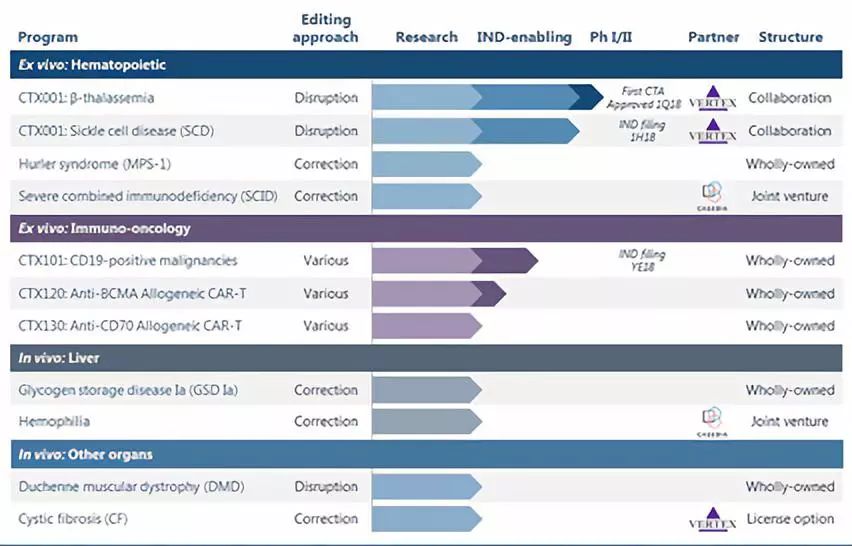
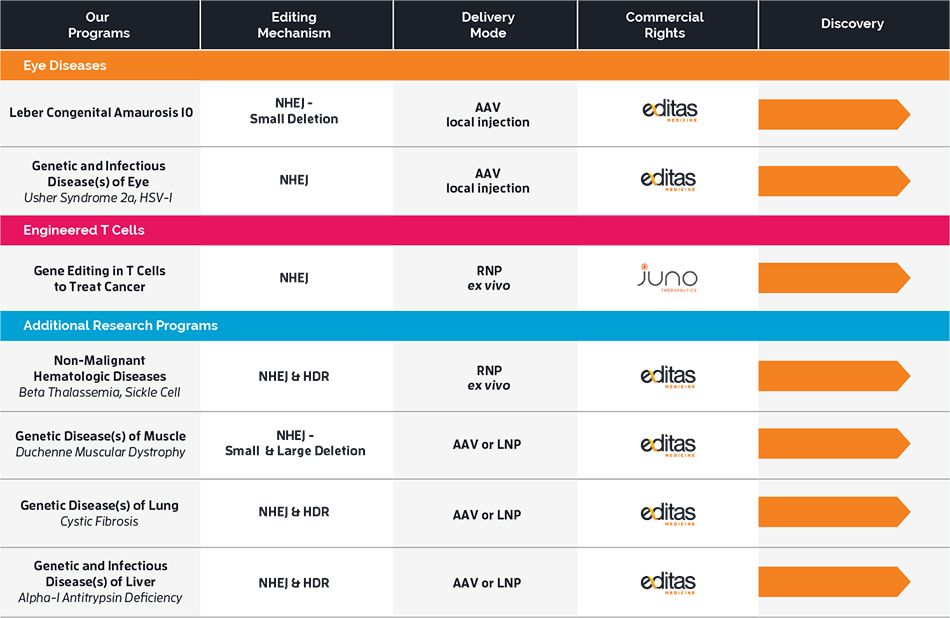
CRISPR Therapeutics以及Editas Medicine的pipeline
需要强调的是,这些研究只是早期的一些研究数据,相关公司研究中所使用的细胞究竟会不会在进行CRISPR-Cas9编辑的时候也会受到p53的干扰从而产生p53缺陷细胞的富集,现在也还是未知数。
而且我觉得大家所担心的诱发癌症风险很有可能只是在多能干细胞的研究中相对容易出现。因为这很大程度上是由多能干细胞本身的特性导致的。
实验中常用的诱导多能干细胞存在p53突变的比例特别高,能够达到3.5%,而在转录组测序中经常使用的多能干细胞其突变率更是高达29%。再结合该类细胞对于DNA损伤反应的敏感度非常高,因此基于这些类型的细胞中出现基因编辑之后p53缺陷细胞的富集的现象也不是什么奇怪的事情。
其实早在去年七月诺华这篇文章的preprint版就已经在bioRxiv上线,但当时并没有引起很大的反响。而之所以本周一因为这两篇文章的上线CRISPR相关公司的股票集体下跌,很有可能是由于媒体报道中所使用的“引发癌症”的标题太引人注目所导致的。
其实这也不是CRISPR第一次受挫,2017年的时候Nature Methods上的一篇文章报道CRISPR能够引发大范围的脱靶效应,但这篇文章在今年三月份撤稿。今年一月bioRxiv又上线了一篇文章称人体能够对Cas9产生免疫反应。相同的是,这些文章的上线都能够引发相关公司股价的震荡。
但无论是脱靶效应,还是p53,抑或是免疫反应,这些都不是科学家意料之外的现象,而且也不是不存在相应的解决方案。但显然很多投资者对此并不了解。
上个月Loncar在twitter上弄了个投票,问大家为什么认为CRISPR Therapeutics是CRISPR领域最有价值的公司,多数人的答案是因为他名字里有CRISPR这个单词。
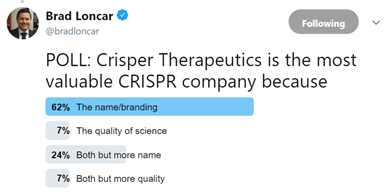
虽然听起来很搞笑,但我想很大一部分投资者其实并不理解什么是CRISPR (见:未来即现在:CRISPR技术如何改变世界)。由于媒体报道引发的错误认知使很多人对这项技术产生了过高的预期。这大概也可能是这些公司市值目前如此之高的原因之一吧。
虽然CRISPR技术从2012年诞生以来已经对基础科研领域产生了革命性的影响,但是想要将其应用于疾病的治疗,其实还有非常长的路要走。
去年Plos One上有一篇文章通过数据分析发现,从新技术出现到有相关药物上市要花费将近三十年的时间,而CRISPR技术从诞生到现在也不过短短六年的时间。
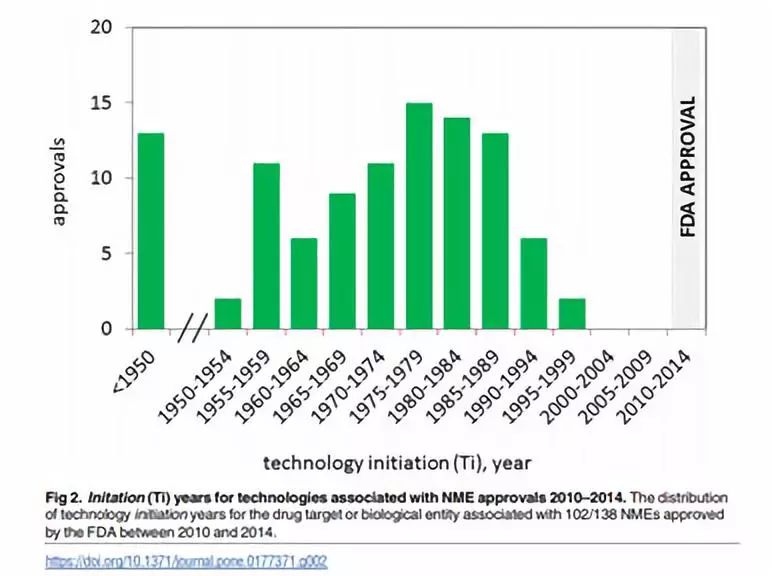
即使是这两年大热的CAR-T技术从诞生到现在也已经经历了二三十年的时间(见:CAR-T传奇)。我之前写过很多技术的科普文章,写这些文章的一个很重要的目的就是提醒大家将新的技术,新的药物想要应用于临床远比很多人想象中的要困难,CRISPR也不例外。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发