明星标志物TMB肿瘤突变负荷的现状与未来
| 导读 | 近来PD-1/PD-L1免疫检查点抑制剂成为了癌症治疗领域的后起之秀,不断打破着各类癌症治疗格局,为今年大小会议最为关切的话题。同时大量数据表明,根据如PD-L1表达、TMB(Tumor Mutation Burden)肿瘤突变负荷等,精确筛选获益人群,应用免疫治疗的效果更佳。 |
TMB定义为肿瘤组织每兆碱基体细胞碱基替换及插入缺失突变的突变总数。
Lawrence等1发表于2013年Nature杂志上的一篇著名文章,通过对3083个癌-癌旁组织的病患进行全外显子组测序,在 Illumina HiSeq flowcells平台上高通量检测,平均覆盖深度达118X以上。
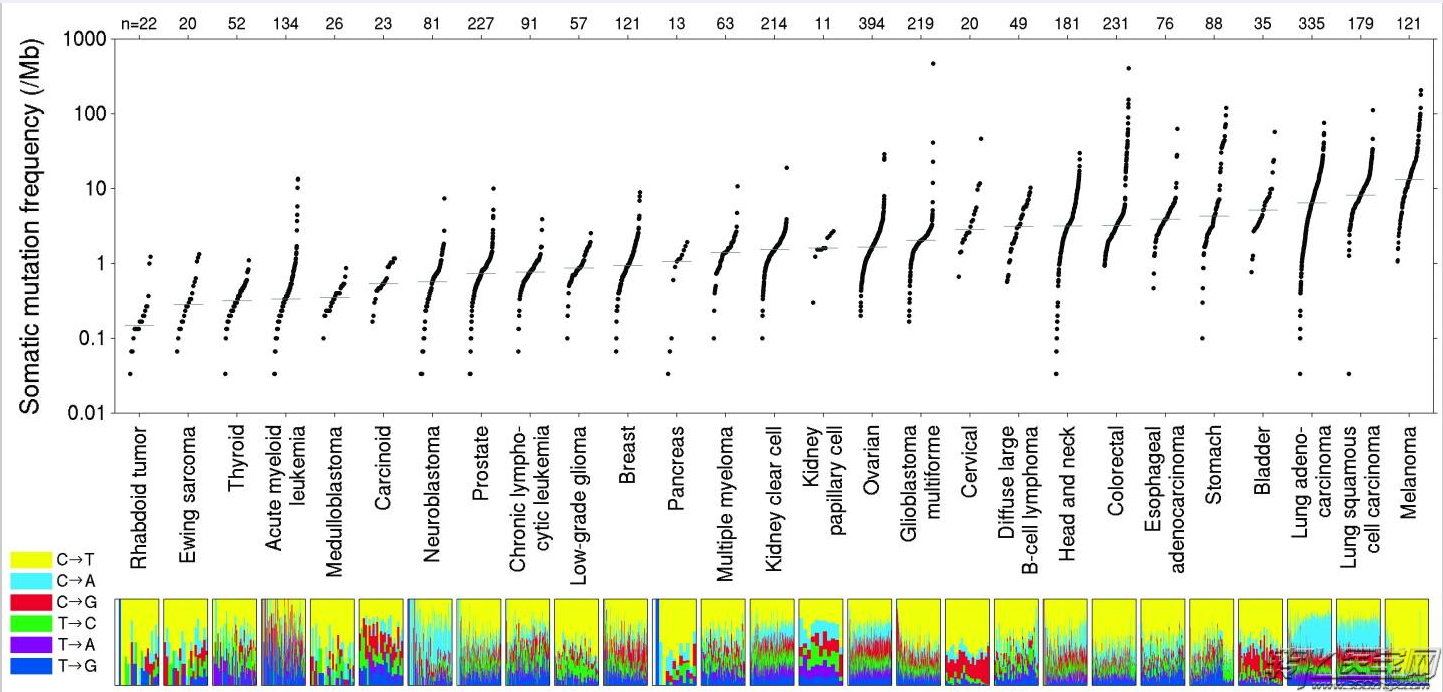
3083例外显子体细胞突变频率分布
结论发现各种瘤种的体细胞突变率大相径庭,范围从散布于<0.1每兆碱基到数百每兆碱基不等。与慢性致突变性肺癌和恶性黑色素瘤相关的癌症表现出最高的突变患病率。
今年BMS公司的抗PD-1 Opdivo的CheckMate026非小细胞肺癌三期研究未达到统计学终点,引起诸多讨论。后据TMB作为标志物对CheckMate026三期临床试验进行回顾性研究2,结果显示,相比PD-L1,选择TMB作为Opdivo治疗NSCLC的biomarker,能更好地区分获益人群。在TMB高表达的病人中,采用Opdivo进行治疗后,ORR(客观缓解率)和PFS(无进展生存期)结果显著优于化疗,这一结果给我们启示,按照TMB水平进行亚组分析,可以较明确预测接受PD-1/PD-L1抑制剂的获益。
大量研究3已经确定通过全外显子组测序方法,检测的TMB结果与免疫治疗疗效显著相关,比如非小细胞肺癌、黑色素瘤等,全外显子组技术是比较标准通用的方式,在各瘤种间可形成阈值规范。
目前目标区域panel比如,TruSight®Tumor 170(TST170)涵盖与实体瘤相关的170个基因的编码区,覆盖检测点突变,插入缺失,基因融合以及剪接变异。此类商业化panel具有评估实验数据。通过对 TCGA 中5336 个样本进行测试。另外,通过分析具体临床样本TST170-TMB同免疫检查点抑制剂疗效的关系、FFPE样本的全外显子结果和TST170结果的吻合度。
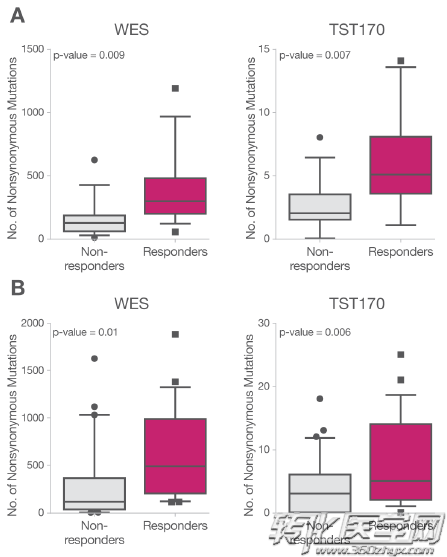
非小细胞肺癌,黑色素瘤TST170-TMB与PD-1治疗反应率
评估结论显示,TST170靶向目标测序试剂,与全外显子测序在评估肿瘤TMB状态方面,具有较高相关性。此类经过验证评估的目标区域panel可作为免疫治疗选择指导的另一种分析工具。
总之,TMB是在预测筛选肿瘤免疫治疗获益人群的有益尝试,与传统免疫标志物以及PD-L1的检测形成互补,未来,TMB在具体瘤种上的阈值将精细化,与PD-L1等联合应用将进一步明确,从而筛选最佳的免疫治疗获益人群,为日前火热的免疫治疗添翼增彩。
1.Lawrence,Nature. 2013 Jul 11;499(7457):214-218
2.Carbone DP, et al, NEJM 2017
3.Chalmers etal.,Genome Medicine 2017 9:34
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发