年度猛料:细胞治疗娶了基因编辑,生了娃叫啥?
| 导读 | 作为一门新技术,基因编辑又存在着构建复杂和价格昂贵的问题,脱靶效应更是制约着其在基因治疗等领域的应用。 |
随着越来越多物种基因组的公布,基因功能的研究成为后基因组时代的重点。基因编辑作为操纵基因的上帝之手,可以实现对基因的定点突变、插入、删除的精确操作;既可以用于正常基因替代突变基因进行性状改良、基因治疗,也可以用于突变基因替代正常基因进行基因功能学的研究;可在干细胞系、动植物中开展,从而设计出用于药物筛选的细胞株、临床前应用的动物模型、改良动植物性状等等。本文中小编仅以基因编辑在免疫细胞治疗领域的应用做以阐述。
三种基因编辑技术的比较
基因编辑技术除了15年吵得沸沸扬扬的CRISPR/Cas9(被誉为诺贝尔级别的技术突破,并获得2015年生命科学突破奖)之外还有归巢内切酶(HEase)、锌指核酸酶(ZFN)以及转录激活因子样效应物核酸酶(TALEN)技术。
iPSC:CRISPR/Cas9与iPSCs相结合,加上靶向型RNA技术(guide RNA,gRNA),在HIV的治疗方面取得了重大突破。HyunJun Kang及其同事在Nature发表文章关于如何有效阻止HIV持续破坏的重大发现!研究者通过CRISPR/Cas9技术诱导iPSC破坏CCR5,进而使免疫细胞对CCR5-HIV-1病毒结合体产生选择性的“漠视”。研究者为保证细胞内的同质性,利用基因编辑将单细胞筛选分类并成功的建立克隆IPSC细胞。研究人员的创新点在于将靶向分型RNA技术+CRISPR/Cas9编辑+IPSCs诱导分化相结合,最终成功产生抗HIV的细胞,并提供了一种新的治疗措施。
HSCs:Luigi Naldini 及同事在人类造血干细胞(HSCs)中成功进行的定向基因组编辑。通过基因编辑的HSCs产生功能性淋巴样细胞,后者相对于那些携带破坏性IL2RG突变的淋巴样细胞具有一个选择性生长优势。该研究成果发表与2014年5月28号发表于《自然》期刊上。
基因编辑在CAR-T中的应用
通过基因编辑技术,对患者的免疫效应细胞T细胞进行体外改造,成为嵌合抗原受体T细胞(即CAR-T),能够特异性识别和杀伤携带表面抗原的肿瘤细胞。可用于治疗淋巴白血病、淋巴瘤等肿瘤。
15年5月,CAR-T疗法的先驱者Juno迈出了重要的一步。Juno已经和基因编辑开拓者Editas公司签订了一项为期三年的合作协议,包括4700万美元的预付款和6亿9千万美元的里程碑奖金,旨在借助Editas开发的CRISPR/Cas9技术辅助来开发CAR-T疗法和TCR疗法以治疗更多的肿瘤类型。而通过Editas公司的基因剪辑技术,Juno公司将可能找到更为有效的实体瘤靶点,从而将实体瘤纳入到肿瘤免疫疗法的治疗范围内,一旦成功,这对整个肿瘤研发领域可谓是意义深远。
以目前的科研与临床进展来看,基因编辑对医疗领域带来的最大突破性进展为CRISPR+CAR-T疗法,从而CAR-T疗法的疗效提高、副作用与成本降低。
解除免疫抑制:在CAR-T细胞中敲除PD1等免疫检查点抑制基因,达到或超过CAR-T+免疫检查点药物的效果;
解除免疫抑制实现off-the-shield: 通过基因编辑方式敲出引起免疫排斥的相关基因,可大批量生产议题CAR-T用于治疗,解决一体治疗、规模生产和标准化治疗等问题;
定向整合CAR-T基因:可以定向插入CAR基因,解除CAR-T本身成瘤风险。
案例:据英媒2015年11月5日报道,英国伦敦一名患白血病的1岁大女婴生命进入最后几个月倒数。面对传统疗法失效,莱拉的医生与Qasim联系上,想借用基因编辑的干细胞来治愈。但是Qasim与纽约生物科技公司Cellectis共同编辑的T细胞(称为UCART19)只在老鼠身上进行过实验。但莱拉的父母还是坚持接受了这个治疗。医生尝试将基因编辑过的T细胞注入她体内,成功消灭癌魔,开创全球首例。研究人员使用TALEN技术对异体T细胞进行编辑,从而实现了三大主要功能:其一,导入CAR19基因以识别癌症细胞;其二,敲掉识别患者正常细胞的相关基因;其三,敲掉引发自体免疫反应的基因。这也是基因编辑技术有史以来第二次被运用在人体上。第一个实验是用来改造HIV病人的T细胞,好增强它们抵抗病毒的能力。不过这些病人与莱拉不同,他们并没有面临即刻的死亡风险。
关于全球首个基因编辑胚胎:15年4月,黄军就在《蛋白与细胞》发表的全世界第一篇关于人类胚胎基因编辑的研究成果,顿时是基因编辑处于舆论的漩涡之中,在12月的国际基因编辑峰会上科学家达成共识:基因编辑技术不应该用于准备建立妊娠的人类胚胎。但是,全球首例基因编辑胚胎竟然要在英国产出了,这是怎么个回事呢???
现在只等英国人类受精与胚胎管理局(HEFA)审核通过就能实现科学家的梦想,而虽然 HEFA 已规定此胚胎存活时间最多不能超过 14 天,也不能放入人体的子宫,这些研究学者仍旧非常看好未来的发展性,相信第一个基改婴儿的诞生将在不久的将来实现。由伦敦弗朗西斯克里克机构所组成的团队向 HEFA 提出申请,希望能够编辑多余的体外受精(IVF)胚胎基因,以做为学术研究,而此项申请将会在 1 月 14 日讨论,最快在这个月内有可能会批准此项申请。此团队的科学家表示,如果 HEFA 批准的话,最快在几个礼拜或几个月内就能制造出第一个基因改造人类胚胎。不过研究者称,如果他们的申请并没有通过审批,也并不会是的情况越来越糟,毕竟英国在这块领域有着很严谨的法律,而他们并不想逾越这条红线,这些研究纯粹只是为了做学术研究。
基因编辑技术作为“上帝之手”,对物种的定向修饰更加的精确、效率更高、时间更短,并且得到的突变可以遗传下去。作为一门新技术,基因编辑又存在着构建复杂和价格昂贵的问题,脱靶效应更是制约着其在基因治疗等领域的应用。不过我们相信,基因编辑与细胞治疗的联姻会推动这门技术在临床应用上大放异彩!本文是转化医学网原创内容,转载请点击获取授权(转化医学网360zhyx.com)
三种基因编辑技术的比较
基因编辑技术除了15年吵得沸沸扬扬的CRISPR/Cas9(被誉为诺贝尔级别的技术突破,并获得2015年生命科学突破奖)之外还有归巢内切酶(HEase)、锌指核酸酶(ZFN)以及转录激活因子样效应物核酸酶(TALEN)技术。
表1、三种基因编辑技术方法的比较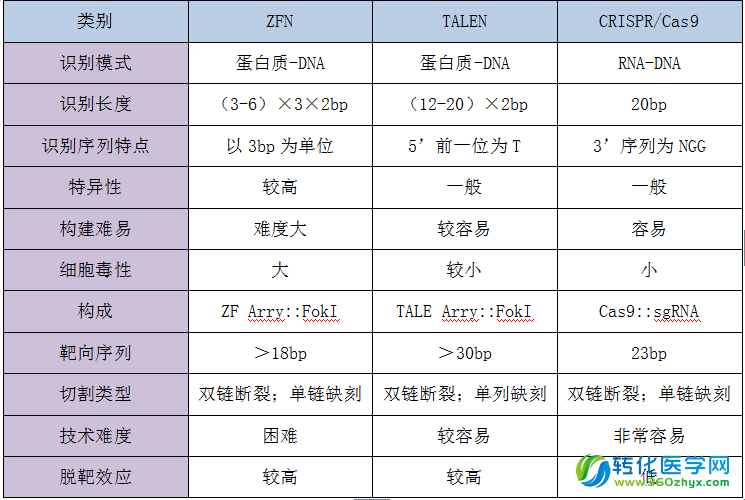
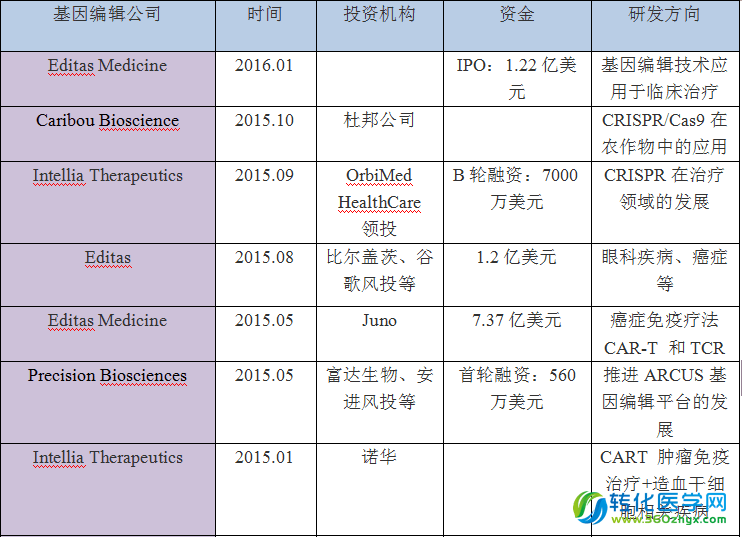
表2、基因编辑公司获得的风投(部分)

基因编辑在干细胞治疗中的应用
基因编辑在干细胞领域如多功能干细胞(Induced pluripotent stem cells,iPSCs)、人类造血干细胞(HSCs)近两年的研究进行的如火如荼。这两个领域的融合被看成是精准医疗和干细胞治疗行业的完美结合。iPSC:CRISPR/Cas9与iPSCs相结合,加上靶向型RNA技术(guide RNA,gRNA),在HIV的治疗方面取得了重大突破。HyunJun Kang及其同事在Nature发表文章关于如何有效阻止HIV持续破坏的重大发现!研究者通过CRISPR/Cas9技术诱导iPSC破坏CCR5,进而使免疫细胞对CCR5-HIV-1病毒结合体产生选择性的“漠视”。研究者为保证细胞内的同质性,利用基因编辑将单细胞筛选分类并成功的建立克隆IPSC细胞。研究人员的创新点在于将靶向分型RNA技术+CRISPR/Cas9编辑+IPSCs诱导分化相结合,最终成功产生抗HIV的细胞,并提供了一种新的治疗措施。
HSCs:Luigi Naldini 及同事在人类造血干细胞(HSCs)中成功进行的定向基因组编辑。通过基因编辑的HSCs产生功能性淋巴样细胞,后者相对于那些携带破坏性IL2RG突变的淋巴样细胞具有一个选择性生长优势。该研究成果发表与2014年5月28号发表于《自然》期刊上。
基因编辑在CAR-T中的应用
通过基因编辑技术,对患者的免疫效应细胞T细胞进行体外改造,成为嵌合抗原受体T细胞(即CAR-T),能够特异性识别和杀伤携带表面抗原的肿瘤细胞。可用于治疗淋巴白血病、淋巴瘤等肿瘤。
15年5月,CAR-T疗法的先驱者Juno迈出了重要的一步。Juno已经和基因编辑开拓者Editas公司签订了一项为期三年的合作协议,包括4700万美元的预付款和6亿9千万美元的里程碑奖金,旨在借助Editas开发的CRISPR/Cas9技术辅助来开发CAR-T疗法和TCR疗法以治疗更多的肿瘤类型。而通过Editas公司的基因剪辑技术,Juno公司将可能找到更为有效的实体瘤靶点,从而将实体瘤纳入到肿瘤免疫疗法的治疗范围内,一旦成功,这对整个肿瘤研发领域可谓是意义深远。
以目前的科研与临床进展来看,基因编辑对医疗领域带来的最大突破性进展为CRISPR+CAR-T疗法,从而CAR-T疗法的疗效提高、副作用与成本降低。
解除免疫抑制:在CAR-T细胞中敲除PD1等免疫检查点抑制基因,达到或超过CAR-T+免疫检查点药物的效果;
解除免疫抑制实现off-the-shield: 通过基因编辑方式敲出引起免疫排斥的相关基因,可大批量生产议题CAR-T用于治疗,解决一体治疗、规模生产和标准化治疗等问题;
定向整合CAR-T基因:可以定向插入CAR基因,解除CAR-T本身成瘤风险。
表3、 CAR-T+基因编辑的企业“联姻”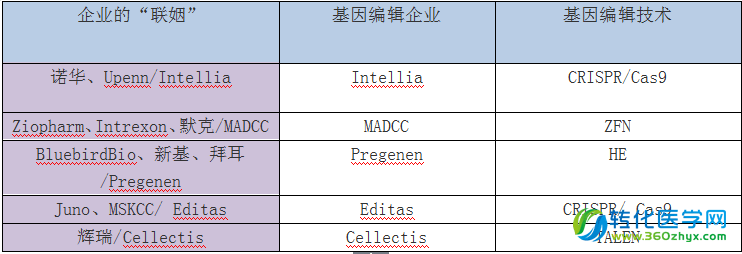
案例:据英媒2015年11月5日报道,英国伦敦一名患白血病的1岁大女婴生命进入最后几个月倒数。面对传统疗法失效,莱拉的医生与Qasim联系上,想借用基因编辑的干细胞来治愈。但是Qasim与纽约生物科技公司Cellectis共同编辑的T细胞(称为UCART19)只在老鼠身上进行过实验。但莱拉的父母还是坚持接受了这个治疗。医生尝试将基因编辑过的T细胞注入她体内,成功消灭癌魔,开创全球首例。研究人员使用TALEN技术对异体T细胞进行编辑,从而实现了三大主要功能:其一,导入CAR19基因以识别癌症细胞;其二,敲掉识别患者正常细胞的相关基因;其三,敲掉引发自体免疫反应的基因。这也是基因编辑技术有史以来第二次被运用在人体上。第一个实验是用来改造HIV病人的T细胞,好增强它们抵抗病毒的能力。不过这些病人与莱拉不同,他们并没有面临即刻的死亡风险。
关于全球首个基因编辑胚胎:15年4月,黄军就在《蛋白与细胞》发表的全世界第一篇关于人类胚胎基因编辑的研究成果,顿时是基因编辑处于舆论的漩涡之中,在12月的国际基因编辑峰会上科学家达成共识:基因编辑技术不应该用于准备建立妊娠的人类胚胎。但是,全球首例基因编辑胚胎竟然要在英国产出了,这是怎么个回事呢???
现在只等英国人类受精与胚胎管理局(HEFA)审核通过就能实现科学家的梦想,而虽然 HEFA 已规定此胚胎存活时间最多不能超过 14 天,也不能放入人体的子宫,这些研究学者仍旧非常看好未来的发展性,相信第一个基改婴儿的诞生将在不久的将来实现。由伦敦弗朗西斯克里克机构所组成的团队向 HEFA 提出申请,希望能够编辑多余的体外受精(IVF)胚胎基因,以做为学术研究,而此项申请将会在 1 月 14 日讨论,最快在这个月内有可能会批准此项申请。此团队的科学家表示,如果 HEFA 批准的话,最快在几个礼拜或几个月内就能制造出第一个基因改造人类胚胎。不过研究者称,如果他们的申请并没有通过审批,也并不会是的情况越来越糟,毕竟英国在这块领域有着很严谨的法律,而他们并不想逾越这条红线,这些研究纯粹只是为了做学术研究。
基因编辑技术作为“上帝之手”,对物种的定向修饰更加的精确、效率更高、时间更短,并且得到的突变可以遗传下去。作为一门新技术,基因编辑又存在着构建复杂和价格昂贵的问题,脱靶效应更是制约着其在基因治疗等领域的应用。不过我们相信,基因编辑与细胞治疗的联姻会推动这门技术在临床应用上大放异彩!本文是转化医学网原创内容,转载请点击获取授权(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发