干货:那些治疗艾滋病的药物以及在研管线
| 导读 | 全世界大约有三千四百万人感染了艾滋病毒。艾滋病毒感染标志就是CD4+ T淋巴细胞进行性衰减以及在较小程度上,CD8+ T淋巴细胞和外周血单核细胞的逐步衰减。免疫系统的退化会导致威胁生命的伺机性感染和艾滋病。 |
现有治疗药物
5个主要药物类别中的26种活性药物成分(APIs)靶向病毒生命周期的不同阶段,已被批准用于艾滋病的抗逆转录病毒治疗(ART)。
病毒进入宿主CD4+ T淋巴细胞的入口经趋化性细胞因子病毒包膜糖蛋白gp41 和 gp120所推动,该糖蛋白会与宿主细胞外表的CD4受体和趋化性细胞因子受体结合,比如趋化性细胞因子 CC-模体 受体 5 型(CCR5)。然后病毒编码逆转录酶促使cDNA的合成,而另一个病毒蛋白,整合酶,负责将病毒的DNA整合到宿主的基因组中。病毒还编码一种可将病毒Gag多聚蛋白裂解为数种成熟蛋白的蛋白酶,成熟蛋白中包括了衣壳蛋白,可组装成锥形核并将病毒基因组和酶包裹在里面。然后完整组装的病毒能够从宿主细胞中萌出而重新进入血流中。目前,5个非核苷类逆转录酶抑制剂(NNRTIs)、7个核苷类逆转录酶抑制剂(NRTIs)、9个蛋白酶抑制剂、3个整合酶抑制剂和2个病毒进入抑制剂(一个靶向CCR5,一个靶向gp41)艾滋病药物获批上市。
抗逆转录病毒治疗(ART)以多于一种药物类型的三联药物组合占主导地位,三种多药物类型组合及四种单一片剂 NRTI 的药物组合已经成功开发。目前,推荐的一线ART治疗药物是Atripla(吉利德/百时美施贵宝),2006年批准上市,所含有的药物成分为NNRTI类的依法韦仑(efavirenz)和NRTI类的恩曲他滨(emtricitabine)、替诺福韦富马酸(tenofovir disoproxil fumarate, TDF),剂量为每日一片。一个固定剂量的NRTI恩曲他滨、替诺福韦富马酸复方产品也以特鲁瓦达(Truvada,吉利德)为商品名开发上市。
Stribild(吉利德)是4合1型一个治疗复方,该复方含有整合酶抑制剂埃替格韦(elvitegravir),组合了emtricitabine和TDF,并用药物代谢增强剂cobicistat增效。该药不像Atripla中应用了efavirenz成分,没有神精精神方面副作用,基于其与Atripla有效性和安全性的比较,该药于2012年获批上市。
Complera(吉利德/杨森制药)是一种单一片剂药物,于2011年批准上市,由NNRTI抑制剂利匹韦林(rilpivirine)和恩曲他滨/ /替诺福韦酯三种药物成分组成。由于与Atripla对比,有更好的药物安全性和抗病毒活性,可作为对Atripla不耐受病人的备选药物。Complera的应用仅局限于低基线病毒载量的病人,因为对高毒载量的病人治疗失败的频率要高得多。
典型的二线治疗采用多药片方案,包括2个核苷类逆转录酶抑制剂和1个蛋白酶抑制剂(通常是阿扎那韦atazanavir(锐艾妥 Reyataz; 百时美施贵宝)),用利托那韦ritonavir(Norvir雅培,艾伯维)增效,利托那韦最早是作为蛋白酶抑制剂开发的,但研究发现它还具有增加其它药物生物利用度的作用,通过细胞色素 P450 3A4(CYP3A4)酶途径抑制药物代谢。
三线药物治疗还很难界定,因为病人可能会发展成多重耐药。 所以治疗选择只局限于一些新类别的药物,如整合酶抑制剂、二代非核苷类逆转录酶抑制剂、蛋白酶抑制剂和病毒进入抑制剂。
大多数抗逆转录病毒类药物都有肝脏毒性,蛋白酶抑制剂会提高胆固醇水平。
治疗依从性差会导致病毒耐药,这也要求相关药物对病毒耐药有较高遗传屏障。
研发管线
艾滋病(HIV)研发管线规模大(417个分子实体)且创新度高,含有199个新型产品(包括121种疫苗,其中77种为治疗性疫苗)。大部分的新型候选药物,包括疫苗、Gag和衣壳蛋白抑制剂都在临床前和I期临床研究阶段,研发管线后期主要被现有药物靶点和固定剂量药物组合所占据(图1)。
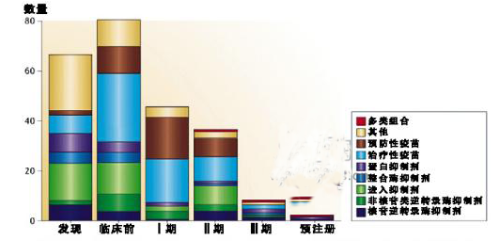
图1 艾滋病研发管线中的药物作用机理
备注:其他包括但不限于Gag抑制剂、衣壳蛋白抑制剂、病毒体感染性因子抑制剂、核糖核酸酶 H抑制剂、细胞周期蛋白依赖性激酶抑制剂、干扰素和白细胞介素受体激动剂、蛋白激酶C活化剂、哺乳动物雷帕霉素靶点抑制剂、和α1抗胰蛋白酶及Toll样受体 3 激动剂。
作为ART的辅助疗法,治疗性疫苗具有特别的研究兴趣,尽管引入了HIV特异性T淋巴细胞免疫应答,但是到目前为止,临床试验结果令人失望。疫苗设计的挑战在于刺激性特异免疫系统武器的复杂性,周围有效分子抗原位点的不确定性以及免疫调节干预的最佳时机掌握。治疗性疫苗临床研究的退出率很高。IR‑103(Remune) Immune Response BioPharma公司研发,该疫苗处于临床 Ⅲ期阶段,含有HIV-1核心成分,包括p24 Gag 衣壳蛋白,疫苗设计目的是为了刺激体液和细胞的免疫应答。然而,现有的数据表明其缺乏显著的临床益处。
在已确立的药物类别中,病毒gp41和共受体进入抑制剂在研发管线中的候选药物数目最高。这些新药仍具有很高的失败率,这主要是由于病毒包膜蛋白的遗传变异,这会引起病毒感受性的降低。
Tobira Therapeutics公司的Cenicriviroc是一种处于Ⅱ期研发阶段靶向于CCR5的进入抑制剂(表1)。该药物也可抑制CCR2,此趋化因子受体具有促进单核细胞炎症,与HIV死亡率具有密切关系的一种情况。Cenicriviroc与Truvada的组合,证明与Atripla药物活性成分疗效相似,而且对初治患者的不良事件更少。Ⅲ期临床试验将比较cenicriviroc和核苷逆转录酶抑制剂拉米夫定((ViiV Healthcare公司)的组合与Truvada疗效。
百时美施贵宝的censavudine和Avexa公司的apricitabine是潜在的二线核苷逆转录酶抑制剂类药物,分别处于Ⅱ期和Ⅲ期开发阶段。这两种药都显示出抗带M184V突变的HIV逆转录酶作用,M184V唯一的突变会引起对核苷逆转录酶抑制剂拉米夫定高水平耐药性(表1)。特别是对保持拉米夫定作为二线治疗的患者,因为该药对M184V突变病毒的选择性作用以维持M184V突变,因此,这使得它更频繁与其他的核苷逆转录酶抑制剂同时使用。临床Ⅱ期结果显示含有apricitabine的治疗方案,与含有拉米夫定或censavudine的治疗方案相比,更能降低病毒载量。
在研发后期产品中也具有3种成分的固定剂量复方。吉利德/日本烟草公司正在研发的单片剂疗法由elvitegravir、cobicistat、tenofovir alafenamide (TAF)和恩曲他滨,是Stribild的改良配方,目前处于Ⅲ期研发阶段。TAF,一种新的tenofovir前药,与TDF比较,可以改善淋巴细胞和肝细胞对它的吸收,从而减少tenofovir引起的肾脏不良反应事件,同时对病毒抑制保持相同的效果。该复方将会成为Stribild的替代品,特别是对那些肌酐水平高可发展成肾脏不良反应风险高的患者。
Cobicistat,一种细胞色素 P450 3A4酶抑制剂,不具有直接的抗病毒活性,由于对产生耐药的风险较小,将会与Norvir竞争。和Norvir一样,用于增强蛋白酶抑制剂阿扎那韦的疗效,Cobicistat促进的阿扎那韦新配方(吉利德/百时美施贵宝)已在预注册阶段。由于和Norvi比较,在有效性和安全性方面都不处于劣势,将来还要面对仿制药阿扎那韦的竞争,该品种的市场潜力的期望值是中等。
最受瞩目的预注册新药是ViiV Healthcare/盐野义公司的572-Trii,每日一次单片,包含有最近批准的整合酶抑制剂dolutegravir(Tivicay,ViiV Healthcare)与一线的核苷逆转录酶抑制剂药物阿巴卡韦(Epzicom)和拉米夫定。572-Trii有望成为Atripla和Stribild一个强劲的竞争对手,与Atripla相比,已经表现出卓越的抗病毒活性和较低频的神经精神不良反应事件。
表 1艾滋病研发管线中的重要化合物一览
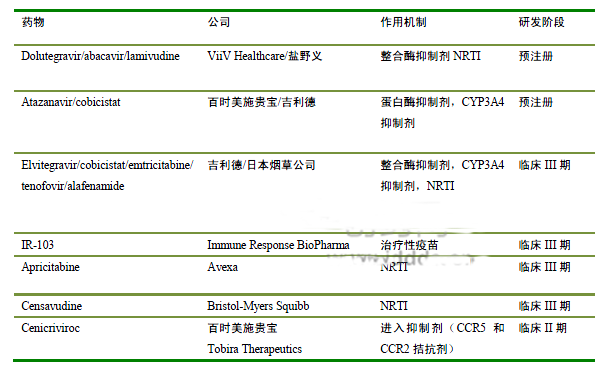
备注:CCR2,趋化性细胞因子 CC-模体 受体 2 型;CCR5,趋化性细胞因子 CC-模体 受体 5 型;CYP3A4,细胞色素 P450 3A4酶;NRTI,核苷类逆转录酶抑制剂;
市场前景
Atripla,2006年上市,艾滋病药物市场最成功的产品,2013年的销售额是37亿美元,将于2018年在欧洲、2021年在美国失去专利保护,而其活性药物成分会在2018年前专利保护到期。,作为最昂贵的ART治疗药物,Stribild现在处于一线治疗备选药物的位置,2013年的销售额为5.39亿美元。
尽管与现有治疗手段相比,研发管线中后期的产品只表现出有限的临床改进(在研发管线中最值得期待的572-Trii除外),这些产品针对毒性和耐药性,对现有的抗病毒药物进行有效的补充。随着“me‑too”组合的加入,治疗规则的重建后,简化组合方案仍然是HIV治疗的支柱。艾滋病药物市场将受到专利到期、财政压力的影响,逐渐趋向于更加便宜而同等有效的选择。然而这种改变将会因为Stribild和572‑Trii,的强势加入而抵消。不断增长的艾滋病接受治疗人数总量(归因于诊断率的提高和对早期治疗的重视)将驱使8个主要的艾滋病市场(美国、加拿大、日本、法国、德国、意大利、西班牙和英国)有轻微的增长,从2012年的123亿美元到2018年的163亿美元。
HIV药物的开发仍将充满挑战,淘汰率甚至可达到98%,高于平均水平的试验持续时间和风险共担的合作伙伴关系将会成为该领域新药开发的趋势。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发