CTM | 王欣玲/姜世勃/孙蕾合作团队破解蝙蝠MERS相关冠状病毒的“黑箱”:预测融合中间态并打造“双头导弹”式广谱抑制剂
| 导读 | 上海市重大传染病和生物安全研究院的王欣玲青年研究员、孙蕾研究员、姜世勃教授为本文共同通讯作者;复旦大学孙禄加博士、刘治民博士为本文共同第一作者。 |
冠状病毒感染细胞的关键在于其表面的刺突蛋白受体结合域(S-RBD)能够像“钥匙”一样识别并结合宿主细胞表面的受体(如ACE2),进而启动膜融合和入侵过程。2025年3月,上海市重大传染病和生物安全研究院王欣玲/姜世勃/孙蕾/陆路合作团队在Cell期刊上首次报道了ACE2受体诱导的新冠病毒(SARS-CoV-2)刺突蛋白早期融合中间态构象(E-FIC),并证实该状态是开发病毒融合抑制剂、阻断感染进程的理想靶点。虽然SARS-CoV-2的E-FIC结构已被解析,但多数其他冠状病毒,尤其是具有跨物种传播潜力的MERS相关冠状病毒(MERSr-CoVs),其融合中间态仍是一个未知的“黑箱”。
近期研究发现,一些来源自蝙蝠和水貂的MERSr-CoVs(如NeoCoV、MOW15-22和HKU5)能像新冠病毒(SARS-CoV-2)一样通过ACE2受体感染蝙蝠或哺乳动物(如水貂)的细胞 。特别值得注意的是,分离自中国广东Pipistrelle蝙蝠的一种MERSr-CoV——BtHKU5-CoV-2,能够利用人ACE2受体介导宿主细胞感染。此外,NeoCoV的刺突蛋白只需引入T510F单突变即可获得高效结合人ACE2的能力,提示其具有向人类“外溢”传播的风险(Ma CB. et al., Cell. 2025; Chen J. et al., Cell. 2025; Park YJ. et al., Cell. 2025; Wang N. et al., Nature. 2025)。因此,解析这类病毒的融合机制并开发广谱抑制剂,成为防范未来冠状病毒疫情的重要策略(Jiang S. and Wu F., Cell. 2025)。
2025年9月8日,上海市重大传染病和生物安全研究院的王欣玲/姜世勃/孙蕾合作团队在Clin Transl Med (CTM) 线上发表题为“Predicted early fusion intermediates in the spike of ACE2-utilising bat coronavirus unveil broad-spectrum antiviral mechanisms”的论文。该研究在前期工作基础上,通过结构预测揭示了两种可利用人ACE2受体的蝙蝠MERSr-CoV的早期融合中间态结构,并阐明了新型双靶点抑制剂AL5E对其差异化效果的分子机制。
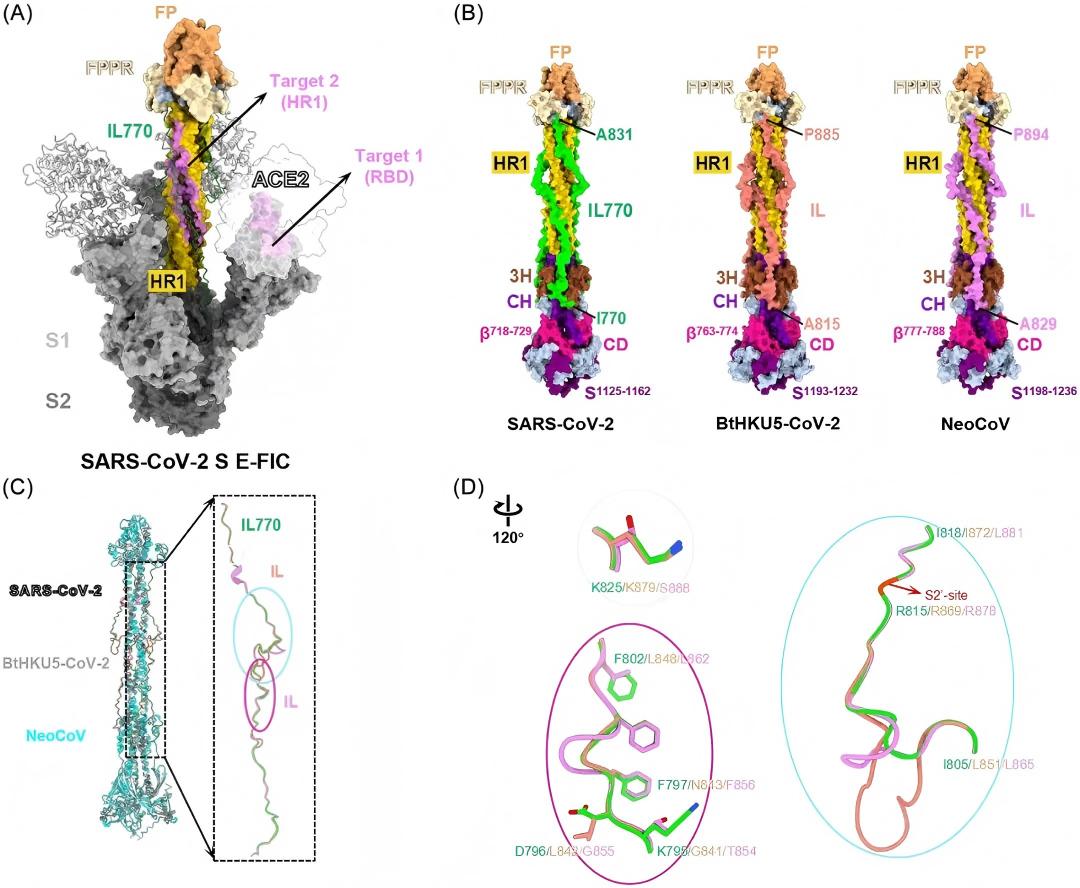
研究聚焦于两种高风险蝙蝠冠状病毒:BtHKU5-CoV-2和NeoCoV T510F。通过结构模拟与功能分析,团队发现一个称为“中间环(Intermediate Loop, IL)”的关键区域,该区域在E-FIC中起到稳定结构的作用,并作为蛋白酶切割激活病毒融合的分子“开关”。与SARS-CoV-2相比,这两种病毒的IL更长,且氨基酸序列存在关键差异,导致其构象更灵活、稳定性更低。
具体而言,BtHKU5-CoV-2的IL含71个氨基酸(残基815–885),NeoCoV含66个(残基829–894),均长于SARS-CoV-2的62个(残基770–831)。尽管S2'蛋白酶切割位点附近的序列较为保守,介导与HR1结构域相互作用的关键残基却存在变异。例如,SARS-CoV-2中的K795、D796、F797、F802和K825在BtHKU5-CoV-2中对应为G841、L842、N843、L848和K879,在NeoCoV中则为T854、G855、F856、L862和S888。这些变化可能削弱IL与HR1之间的相互作用,从而增强IL灵活性。
为何同一个抑制剂对相似病毒效果迥异?机制研究表明:对于BtHKU5-CoV-2,其灵活的IL促使HR1区域明显暴露,使AL5E能够同步高效结合双靶点,实现协同抑制;而在NeoCoV(T510F)中,T510F突变在增强受体结合能力的同时,可能引起蛋白整体的远距离构象调整,导致HR1微移位,超出AL5E双靶点的最优作用范围,从而削弱抑制效能。该假设尚需通过冷冻电镜结构解析进一步验证。
总之,该研究通过结构预测揭示了两种高风险蝙蝠MERSr-CoVs在融合机制上的异同,深入探讨了双靶点抑制剂AL5E的差异化效果与机制。研究表明,针对不同冠状病毒乃至不同变异株,需依据其融合蛋白的构象特征“量体裁衣”,设计和优化抑制策略,为开发广谱、高效的冠状病毒融合抑制剂提供了新思路与理论依据。(转化医学网360zhyx.com)
近期研究发现,一些来源自蝙蝠和水貂的MERSr-CoVs(如NeoCoV、MOW15-22和HKU5)能像新冠病毒(SARS-CoV-2)一样通过ACE2受体感染蝙蝠或哺乳动物(如水貂)的细胞 。特别值得注意的是,分离自中国广东Pipistrelle蝙蝠的一种MERSr-CoV——BtHKU5-CoV-2,能够利用人ACE2受体介导宿主细胞感染。此外,NeoCoV的刺突蛋白只需引入T510F单突变即可获得高效结合人ACE2的能力,提示其具有向人类“外溢”传播的风险(Ma CB. et al., Cell. 2025; Chen J. et al., Cell. 2025; Park YJ. et al., Cell. 2025; Wang N. et al., Nature. 2025)。因此,解析这类病毒的融合机制并开发广谱抑制剂,成为防范未来冠状病毒疫情的重要策略(Jiang S. and Wu F., Cell. 2025)。
2025年9月8日,上海市重大传染病和生物安全研究院的王欣玲/姜世勃/孙蕾合作团队在Clin Transl Med (CTM) 线上发表题为“Predicted early fusion intermediates in the spike of ACE2-utilising bat coronavirus unveil broad-spectrum antiviral mechanisms”的论文。该研究在前期工作基础上,通过结构预测揭示了两种可利用人ACE2受体的蝙蝠MERSr-CoV的早期融合中间态结构,并阐明了新型双靶点抑制剂AL5E对其差异化效果的分子机制。
研究聚焦于两种高风险蝙蝠冠状病毒:BtHKU5-CoV-2和NeoCoV T510F。通过结构模拟与功能分析,团队发现一个称为“中间环(Intermediate Loop, IL)”的关键区域,该区域在E-FIC中起到稳定结构的作用,并作为蛋白酶切割激活病毒融合的分子“开关”。与SARS-CoV-2相比,这两种病毒的IL更长,且氨基酸序列存在关键差异,导致其构象更灵活、稳定性更低。
具体而言,BtHKU5-CoV-2的IL含71个氨基酸(残基815–885),NeoCoV含66个(残基829–894),均长于SARS-CoV-2的62个(残基770–831)。尽管S2'蛋白酶切割位点附近的序列较为保守,介导与HR1结构域相互作用的关键残基却存在变异。例如,SARS-CoV-2中的K795、D796、F797、F802和K825在BtHKU5-CoV-2中对应为G841、L842、N843、L848和K879,在NeoCoV中则为T854、G855、F856、L862和S888。这些变化可能削弱IL与HR1之间的相互作用,从而增强IL灵活性。
这种结构灵活性具有双重效应:一方面,它有利于病毒融合——灵活的IL减少了对HR1的构束,不仅暴露HR1,更促进其与HR2在融合后期快速组装成六螺旋束(6-HB),这是推动最终膜融合与融合孔形成的关键步骤,可能显著提升病毒的感染效率;另一方面,它也成为病毒潜在弱点:不稳定的IL使HR1在融合中间态更早充分暴露,为靶向HR1的融合抑制剂(如AL5E中的EK1组分)提供更易作用的窗口,从而“冻结”融合过程,中断感染。
团队进一步评估了新型双靶点融合抑制剂AL5E的抑制效果。它像“双头导弹”一样,同时靶向刺突蛋白的RBD(受体结合域)和HR1区域,通过双重作用机制牢牢锁住病毒刺突蛋白的构象,阻断其变构与融合进程。实验表明,AL5E对BtHKU5-CoV-2假病毒具有纳摩尔级别的超高抑制活性,效果显著优于单一靶点抑制剂(hACE2和EK1)。然而,该化合物对NeoCoV(T510F)却未表现出显著的抑制增强。
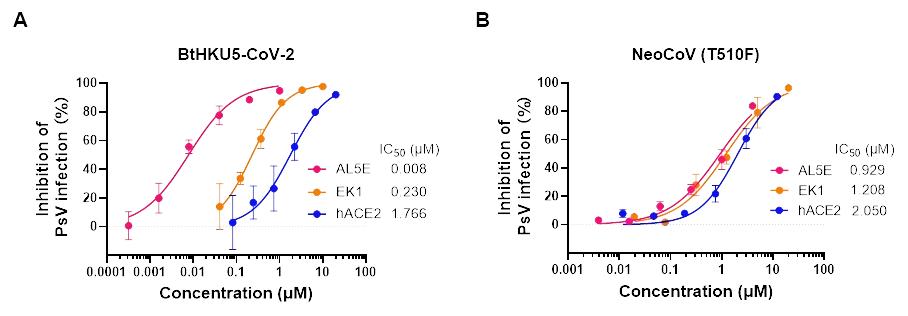
为何同一个抑制剂对相似病毒效果迥异?机制研究表明:对于BtHKU5-CoV-2,其灵活的IL促使HR1区域明显暴露,使AL5E能够同步高效结合双靶点,实现协同抑制;而在NeoCoV(T510F)中,T510F突变在增强受体结合能力的同时,可能引起蛋白整体的远距离构象调整,导致HR1微移位,超出AL5E双靶点的最优作用范围,从而削弱抑制效能。该假设尚需通过冷冻电镜结构解析进一步验证。
总之,该研究通过结构预测揭示了两种高风险蝙蝠MERSr-CoVs在融合机制上的异同,深入探讨了双靶点抑制剂AL5E的差异化效果与机制。研究表明,针对不同冠状病毒乃至不同变异株,需依据其融合蛋白的构象特征“量体裁衣”,设计和优化抑制策略,为开发广谱、高效的冠状病毒融合抑制剂提供了新思路与理论依据。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发