【快讯】全球首个复合佐剂系统重组带状疱疹疫苗(CHO细胞)获批临床
| 导读 | 带状疱疹由VZV感染所致,典型表现为沿身体一侧的神经分布区域(如胸腰段、头面部)出现成簇的水疱 |
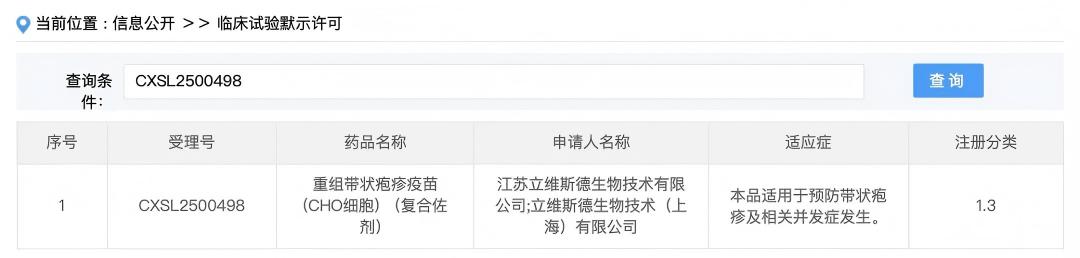
近日,江苏立维斯德生物技术有限公司和立维斯德生物技术(上海)有限公司联合申报的一类新药“重组带状疱疹疫苗(CHO细胞)(复合佐剂)”(项目代号:LWSD603复合佐剂疫苗)的IND申请获得中国国家药品监督管理局药品审评中心(CDE)批准,标志着LWSD603复合佐剂疫苗正式进入临床开发阶段。经过preIND的充分沟通,在正式IND的审评过程中,本品CMC、非临床、临床三个专业0问询,意味着LWSD603复合佐剂疫苗的临床前研究工作非常扎实、药学相关CTD资料的2.3和3.2章节提供的数据翔实可靠,足以一次性全面支撑CDE审评之需并得出可批准的结论。
立维斯德生物将乘LWSD603复合佐剂疫苗IND顺利获批之东风,加速推进临床试验进程,并持续夯实CMC开发保证药物的物质基础,尽早实现LWSD603复合佐剂疫苗的上市获批,为公众预防水痘-带状疱疹病毒(VZV)感染侵袭所致疾病及相关并发症提供可供选择的方案。
LWSD603复合佐剂疫苗
带状疱疹由VZV感染所致,典型表现为沿身体一侧的神经分布区域(如胸腰段、头面部)出现成簇的水疱,伴剧烈疼痛(烧灼感、针刺感或电击痛),常见并发症为带状疱疹后神经痛,疼痛可持续数月甚至数年,严重影响生活质量;头面部带状疱疹还可能累及眼、耳,导致视力/听力受损。50岁以上中老年人及免疫力低下者为易感人群。
此次获批的LWSD603复合佐剂疫苗的抗原为截短的gE蛋白,采用自有的抗原设计技术平台,在与已获批上市的GSK公司Shingrix TM抗原的氨基酸序列高度同源基础上,通过简化的抗原结构优化与动物实验的协同设计,使本抗原的CMC工艺成本、免疫效力等均展现出显著优势。与已上市重组VZV疫苗副反应较大的缺点相比,本项目采用的抗原和全新的复合佐剂在非临床实验中良好的安全性预示在临床中将有更优的安全性。
关于立维斯德生物立维斯德生物成立于 2021 年,专注于创新型疫苗开发,立足全球前沿技术,在研品种管线覆盖婴幼儿、成年人以及老年人。江苏立维斯德生物技术有限公司为立维斯德生物技术(上海)有限公司的全资子公司,公司先后获得江苏省“双创人才”支持、泰州市“113 医药人才特别计划”支持、国家高新技术企业等荣誉。同时与ICGEB(国际遗传工程中心)中国区域研究中心、中国药科大学等科研院所形成战略合作,搭建了病毒类疫苗及重组蛋白类疫苗研发平台,开发的病毒类疫苗以及重组蛋白疫苗为一类新药或填补国内外空白的重大产品,在研产品有4条管线涵盖了5个创新品种,2026年预计有2-3款产品获批 IND 并进入临床。
立维斯德生物团队坚信通过不懈的努力可以开发出先进的疫苗产品,坚信能够实现“让每一个家庭乐享健康”的使命。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发