CTM期刊 | ZSH-2208:揭秘新型视黄酸药物,靶向RARγ–TNFAIP3轴,高效抗击食管癌干细胞!
| 导读 | 2024年12月26日,复旦大学的研究团队在《Clinical and Translational Medicine》上发表了题为“ZSH-2208: A novel retinoid with potent anti-tumour effects onESCCstemcellsvia RARγ–TNFAIP3axis”的研究论文。 |


食管癌作为全球范围内常见的恶性肿瘤之一,其干细胞加速疾病进展,因其强大的自我更新和致瘤能力而给临床治疗带来巨大挑战,其中食管鳞状细胞癌(ESCC)是最主要的类型,占所有食管癌病例的 80% 以上。ESCC 的主要风险因素包括吸烟、饮酒、不良饮食习惯和感染幽门螺杆菌等,其症状包括吞咽困难、胸痛、体重减轻等,通常在晚期才出现,导致治疗效果不佳。目前 ESCC 的治疗选择主要包括手术、化疗和放疗,但治疗效果有限,且存在复发和耐药性问题。近年来,癌症干细胞(CSCs)被认为是导致癌症复发和耐药性的主要原因,而肿瘤重编程细胞(TRCs)作为 CSCs 中的一种,具有更强的自我更新和肿瘤生成能力,成为治疗癌症的重要靶点。维甲酸(RA)和维甲酸受体(RARs)在细胞生长、分化和凋亡等过程中发挥重要作用,RA 类似物在多种癌症治疗中展现出潜力。
2024年12月26日,复旦大学的研究团队在《Clinical and Translational Medicine》上发表了题为“ZSH-2208: A novel retinoid with potent anti-tumour effects onESCCstemcellsvia RARγ–TNFAIP3axis”的研究论文。该研究开发了一种新型的维甲酸类似物 ZSH-2208,发现其对 ESCC-TRCs 具有显著的抑制作用,并阐明了其作用机制与 TNFAIP3 基因的表达调控相关。TNFAIP3 是一种与肿瘤发生发展相关的基因,在细胞凋亡、炎症和免疫调节等过程中发挥重要作用,其表达水平与多种癌症患者的预后相关,高表达往往预示着较差的预后。在研究方法上,研究团队采用了体内和体外实验相结合的方式。他们首先通过药物筛选确定了ZSH-2208的化学结构,并比较了其与其他药物(如WYC-209、多柔比星和维A酸)在抑制肿瘤细胞增殖方面的效果。随后,通过CCK-8测定法确定了ZSH-2208对ESCC细胞和ESCC-TRCs的半数抑制浓度(IC50)。此外,还进行了克隆球形成实验、迁移和侵袭实验、细胞划痕实验以及流式细胞术等,以全面评估ZSH-2208对ESCC-TRCs生长、迁移、侵袭、细胞周期和凋亡的影响。

研究团队在开发一系列新兴维甲酸类化合物的基础上,通过Schrödinger分子对接模拟的手段,反复调整结构的性能评估,对化合物的药效、安全性和稳定性进行优化,旨在提高化合物食管鳞状细胞癌(ESCC)干细胞的抗肿瘤效果,同时最小化其毒副作用,最后确定了ZSH-2208为最具潜力的候选药物。

ZSH-2208作为一种选择性RARγ调制剂,其化学结构与已知的RARs泛拮抗剂(如ATRA和无环维甲酸ACR)相似。通过分子对接模拟,证实了ZSH-2208与RARγ蛋白具有强大的结合亲和力,这为其后续的生物功能奠定了基础。研究发现,ZSH-2208能够通过减少RARγ蛋白表达来实现显著抑制RARγ蛋白下游的TNFAIP3表达。TNFAIP3在人体免疫系统中扮演着重要角色,同时在癌症生物学中也具有双重作用。在ESCC中,TNFAIP3的高表达与肿瘤细胞的增殖、迁移和侵袭能力增强以及凋亡抑制有关。通过抑制TNFAIP3表达,ZSH-2208能够间接影响ESCC-TRCs的多种细胞行为,包括抑制增殖、迁移和侵袭,以及促进凋亡,这些细胞行为的改变是ZSH-2208发挥抗肿瘤作用的重要机制之一。

研究团队首先通过体外实验(克隆形成实验和克隆球形成实验)证实了ESCC-TRCs 具有典型的 CSCs 特性,包括更强的增殖、迁移和侵袭能力,以及更高的肿瘤生成潜力,而ZSH-2208在低浓度下对ESCC细胞和ESCC-TRCs的生长均有显著的抑制作用,其 IC50 值远低于 ESCC 细胞系。此外,ZSH-2208 还可以抑制 ESCC-TRCs 的迁移和侵袭能力,并降低干细胞标志物 CD44 的表达水平。
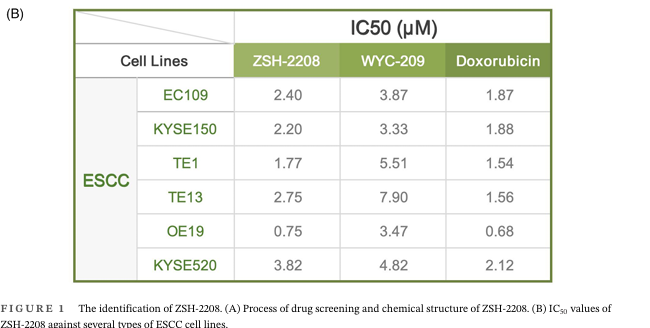
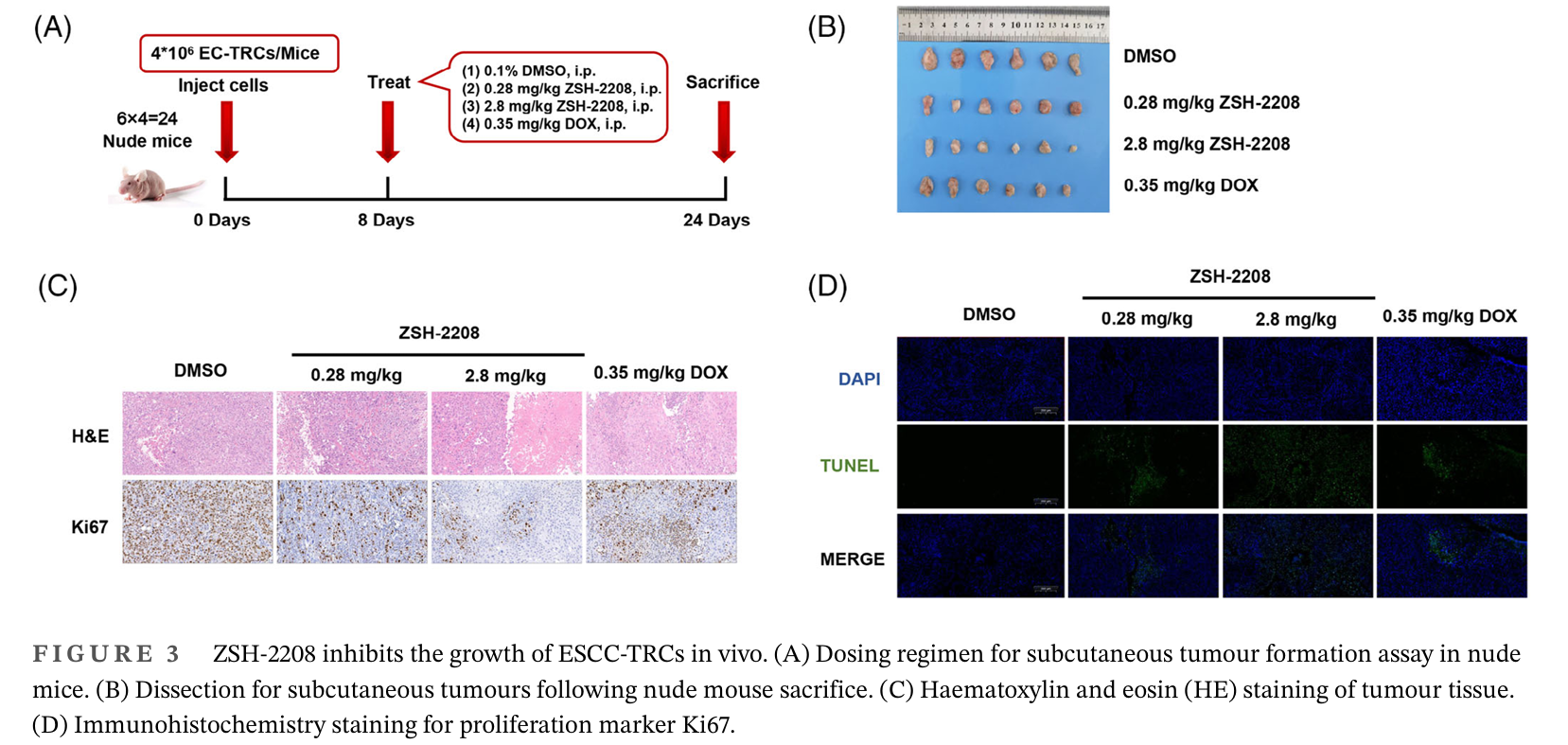
体内实验结果显示,低剂量的ZSH-2208显著抑制了裸鼠皮下肿瘤的生长。高剂量组的肿瘤重量明显低于阳性对照组,这表明ZSH-2208 可以有效抑制裸鼠皮下移植瘤的生长,并促进肿瘤细胞凋亡,且未观察到明显的毒副作用。此外,组织切片和H&E染色未发现ZSH-2208在皮下肿瘤形成过程中存在不良影响。所有治疗组的裸鼠体重均无显著变化,表明ZSH-2208作为治疗药物是安全的。
紧接着研究团队通过构建TNFAIP3敲低和过表达的ESCC-TRCs模型,进一步验证了RARγ–TNFAIP3轴在ZSH-2208抗肿瘤作用中的重要性。RNA 测序和染色质免疫沉淀测序结果显示,ZSH-2208 可以抑制 RARγ 蛋白与 TNFAIP3 基因启动子区域的结合,从而下调 TNFAIP3 的表达水平。TNFAIP3敲低能够显著抑制ESCC-TRCs的迁移和侵袭能力,而过表达TNFAIP3则能够部分逆转ZSH-2208对克隆球形成的抑制作用。也就是说,ZSH-2208通过选择性结合RARγ并抑制其下游TNFAIP3的转录,从而调制RARγ–TNFAIP3轴,进而影响ESCC-TRCs的多种细胞行为,发挥强大的抗肿瘤作用。

研究团队探究了TNFAIP3在ESCC患者队列中的临床意义,收集了60例ESCC患者的肿瘤和邻近区域的组织样本。将这些样本整合到组织微阵列(TMA)中,使用免疫组织化学染色评估TNFAIP3蛋白水平。研究发现肿瘤组织中TNFAIP3的表达明显高于邻近组织。
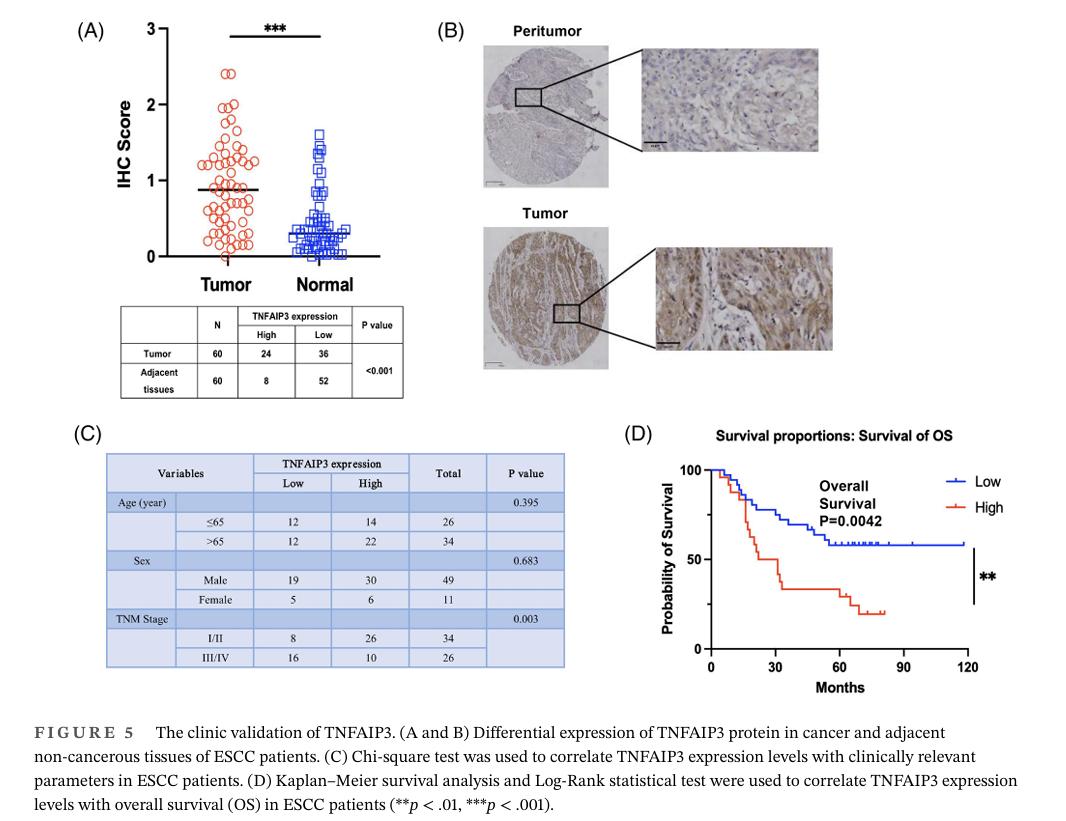
Chi-square test结果显示,TNFAIP3的表达在不同年龄组和性别之间没有显著差异。然而,TNFAIP3的表达与TNM分期之间存在显著相关性。通过Kaplan-Meier生存分析和Log-Rank检验,研究ESCC患者TNFAIP3表达水平与总生存期(OS)的相关性。结果显示低TNFAIP3蛋白表达与ESCC预后改善之间存在显著相关性。采用COX回归模型评价各因素对ESCC患者生存期的影响。单变量分析结果表明,TNFAIP3的表达水平和TNM分期独立预测ESCC患者的预后,这进一步支持靶向TNFAIP3表达作为治疗这些患者的有希望的策略的潜力。

Chen R, Huang X, Hou J, et al. ZSH-2208: A novel retinoid with potent anti-tumour effects on ESCC stem cells via RARγ–TNFAIP3 axis. Clin Transl Med. 2025; 15:e270148. https://doi.org/10.1002/ctm2.70148


带您了解CTM杂志
CTM竭诚欢迎临床医生、研究人员、决策者和业界人士免费阅读期刊并积极向期刊投稿。

 腾讯登录
腾讯登录





还没有人评论,赶快抢个沙发