TPMT
| 导读 | 概述
TPMT是存在于哺乳动物和禽类细胞中的一种非金属依赖性酶,能利用S-腺苷-L-甲硫氨酸(SAM)作为甲基的供体和底物结合,特异地催化杂环类和芳香类化合物苯环6-位硫原子的甲基化。该酶在嘌呤类药物的抗白血病作用中起关键作用,其DNA编码序列上的核苷酸突变是造成此类药物不同强度的细胞毒作用的基础。
TPMT广泛分布于人体的各大组织和器官,如肝脏、肾脏、胃肠道、肺、脑、血液,以及胎盘等... |
概述
TPMT是存在于哺乳动物和禽类细胞中的一种非金属依赖性酶,能利用S-腺苷-L-甲硫氨酸(SAM)作为甲基的供体和底物结合,特异地催化杂环类和芳香类化合物苯环6-位硫原子的甲基化。该酶在嘌呤类药物的抗白血病作用中起关键作用,其DNA编码序列上的核苷酸突变是造成此类药物不同强度的细胞毒作用的基础。
TPMT广泛分布于人体的各大组织和器官,如肝脏、肾脏、胃肠道、肺、脑、血液,以及胎盘等。成年人肝细胞的TPMT浓度和血液组织中的TPMT浓度几乎呈直线相关。TPMT的浓度及活性在人体各组织内、甚至肿瘤组织中均存在密切相关性,测定红细胞中的TPMT浓度即可大致估计其他组织的酶活性。
TPMT是嘌呤类药物代谢过程中决定巯基鸟嘌呤核甘酸(TGNs)浓度的关键酶。6-巯基嘌呤(mercaptopurine,6-MP),一种嘌呤类抗癌药物,在体内可以转化成TGNs,后者在DNA合成中整合到肿瘤细胞DNA和RNA分子中,影响DNA的复制及RNA的表达而发挥抗肿瘤作用,但过多的TGNs将导致严重的毒副作用。临床上给予标准剂量的嘌呤类药物治疗时,部分患者发生严重的造血毒性反应,这种对药物的不耐受现象提示可能存在TPMT活性缺陷。对此类患者的研究表明,其中绝大多数患者存在遗传性TPMT活性降低或缺失,因而导致对药物毒性的敏感性增加,造成骨髓抑制和肝细胞损害等。如果用药之前对患者的TPMT酶活性进行测定,可以预测并避免或减少毒性反应的发生,而通过TPMT基因分型检测是预测TPMT酶活性的有效措施。
相关药物介绍
嘌呤类抗癌药物如6-巯基嘌呤(6-MP)、6-巯鸟嘌呤(6-TG)及免疫抑制药物硫唑嘌呤(AZA)均为无活性的药物前体,在体内需经过一系列的代谢过程生成巯基鸟嘌呤磷酸盐(TGNs)方能发挥其细胞毒性作用。临床上常作为急性白血病化疗、器官移植及自身免疫性疾病治疗的免疫抑制剂,如6-MP用于儿童急性白血病的维持治疗,AZA用于治疗类风湿性关节炎和克罗恩(Crohn)病等。
嘌呤类药物属于抑制嘌呤合成途径的细胞周期特异性药物,化学结构与次黄嘌呤相似(图1),因而能竞争性地抑制次黄嘌呤的转变过程。这里主要介绍6-MP。6-MP是腺嘌呤6位上的-NH2被-SH取代的衍生物。在体内先经过酶的催化变成硫基次黄嘌呤单磷酸盐(TIMP)后,阻止肌苷酸转变为腺核苷酸及鸟核苷酸,干扰嘌呤代谢,阻碍核酸合成,对S期细胞作用最为显著,对G1期有延缓作用。肿瘤细胞对6-MP产生耐药性是由于耐药细胞中6-MP不易转变成TIMP或产生后迅速降解。6-MP起效慢,主要用于急性淋巴细胞白血病的维持治疗,大剂量对绒毛膜上皮癌亦有较好疗效。常见骨髓抑制和消化道粘膜损害,少数患者可出现黄疸和肝功能损伤。
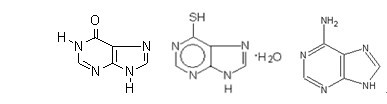
图1 次黄嘌呤(左)、6-巯基嘌呤(中)和腺嘌呤(右)化学结构图基因结构
TPMT全称为thiopurine S-methyltransferase,中文名为硫嘌呤甲基转移酶。TPMT基因位于染色体的6p22.3位置,全长26,832bp,共有11个外显子,mRNA长3,258nt,编码由245个氨基酸残基组成的蛋白质。
基因分子生物学功能
TPMT是一种非金属依赖性酶,以S-腺苷-L-甲硫氨酸(SAM)作为甲基的供体,特异地催化杂环类和芳香类化合物苯环6-位硫原子的甲基化,起到甲基转移的作用。正因为如此,TPMT在硫嘌呤类药物的体内代谢中起着重要作用。硫嘌呤类药物在临床上用于急性白血病和一些自身免疫疾病的治疗,TPMT的活性与这类药物的临床疗效和毒性密切相关。
6-巯基嘌呤(6-MP)和硫鸟嘌呤(6-TG)是众多抗白血病药物中使用最广泛的两种药。6-M P和6-TG均为无活性的前体药,需在体内经代谢生成巯基鸟嘌呤核甘酸(Thioguaine nuclectides,TGNs) 后才能产生细胞毒性。另外,这两种药物可被TPMT催化发生甲基化反应或者经黄嘌呤氧化酶(Xanthineoxidase)催化成硫脲酸,这两种途径来减少TGNs。然而在造血系统、组织中黄嘌呤氧化酶的活性极低,从而使TPMT催化的甲基化反应成为TGNs主要的代谢途径。
参与的通路
TPMT能利用S-腺苷-L-甲硫氨酸(SAM)作为甲基的供体和底物结合,特异地催化杂环类和芳香类化合物苯环6-位硫原子的甲基化,因此它在硫嘌呤类药物的体内代谢中起着重要作用。硫嘌呤类药物在临床上用于急性白血病和一些自身免疫疾病的治疗,TPMT的活性与这类药物的临床疗效和毒性密切相关。现以TPMT参与6-MP代谢通路(图2)来了解其生物学功能,以及在药物代谢过程中所处的重要地位。
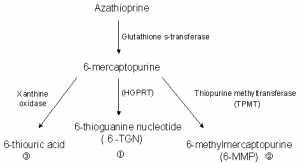
图2 6-MP代谢通路简图
6-MP的代谢途径:①由次黄嘌呤磷酸核糖转移酶(HPRT)催化形成硫基次黄嘌呤单磷酸盐(TIMP)、硫基黄嘌呤单磷酸盐(TXMP)、硫基鸟嘌呤单磷酸盐(TGMP),后者经磷酸化后分别形成二磷酸盐和三磷酸盐。后三种物质统称为TGNs,它整合到肿瘤细胞中影响DNA的复制及RNA的表达,发挥抗肿瘤作用。②6-MP、TIMP、TGMP均可由TPMT催化生成甲基化的衍生物6-meMP、6-meTGMP、6-meTIMP,这些甲基化的化合物属于“无活性”的物质,它们能够抑制磷酸核糖焦磷酸化氨基转移酶(PRPP-AT)的活性,后者是细胞重新合成嘌呤步骤中的关键酶,因此,抑制PRPP-AT的活性就阻断了肿瘤细胞遗传信息的表达,从而达到抗白血病的作用。③由黄嘌呤氧化酶催化形成6-硫基黄嘌呤后再形成尿酸,也可直接生成尿酸排出。
基因对药效的影响
TPMT基因具有遗传多态性,并与酶活性密切相关,表现为常染色体共显性遗传特征(图3)。大约89%的人的TPMT酶活性>6U/ml pRBC,属于高活性;而11%的人的TPMT酶活性为1-5U/ml pRBC,属于中度活性;大约1/300的人的TPMT酶活性<1U/ml pRBC或无法测出,属于低活性。11%有中度活性的人是杂合子,TPMT缺陷的个体是低活性等位基因的纯合子。在使用6-MP时,TPMT的低活性将导致形成高浓度的TGNs,引起明显的造血组织细病毒性,产生严重后果,甚至引起死亡。
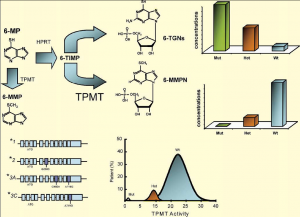
图3 TPMT遗传多态性与其酶活性的关系示意图
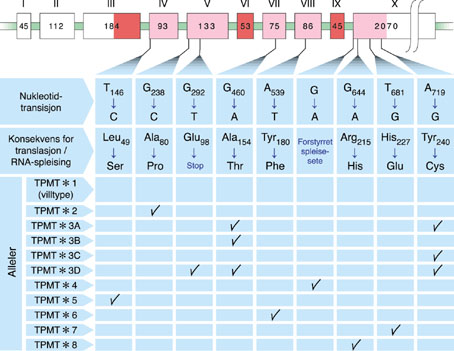
图4 TPMT基因点突变示意图
通过对TPMT缺陷或中等活性个体作基因型-表型分析(genotype-phenotype analysis),发现在TPMT基因的编码区有多种点突变,这些数量有限的点突变构成了TPMT遗传多态性的分子基础。目前,至少有10种点突变类型可以引起TPMT活性改变,它们是TPMT*2、3A、3B、3C、3D和4-8(图4)。而至2006年为止TPMT的SNP总数达到了23个(TPMT*2-*22)[1]。野生型TPMT基因被定义为TPMT*1。按照突变与否来分类,TPMT的基因型可分为野生型基因纯合子(wt/wt)、杂合子(wt/mut)和突变基因纯合子(mut/mut)三种类型。TPMT*2是最早发现的点突变,在外显子5中发生单碱基突变G238C,导致TPMT酶第80位氨基酸改变(Ala→Pro),在酵母中进行表达发现TPMT酶活性下降了100倍[2]。第二个被发现的点突变类型是TPMT*3A,在外显子7和9(过去文献中报道为10)中分别发生单碱基突变G460A和A719G,分别导致TPMT第154位氨基酸改变(Ala→Thr)和第240位氨基酸改变(Tyr→Cys),在酵母中进行表达几乎没有活性。TPMT*3B仅有G460A突变,该突变使MwoI的酶切位点消失。TPMT*3C仅有A7I9G突变,该突变产生了一个Accl的酶切位点。随后其他的点突变类型陆续被发现,但这些突变都非常罕见。
治疗TPMT缺失的病人时,6-MP的剂量要减至常规剂量的6%-10%,以防止出现致命的血液毒性。与此相反,具有高活性TPMT的纯合者会对6-MP治疗产生抗药性。由于红细胞中TPMT的活性与白细胞、肝、肾、及白血病幼稚淋巴细胞中TPMT的活性具有良好的相关性,因此临床上通过检测红细胞中TPMT活性来反映体内其他组织中的TPMT活性。TPMT活性与红细胞中的TGNs浓度呈负相关。与红细胞中TGNs浓度大大超过人群平均值者相比,红细胞TGNs水平较低者的TPMT活性明显升高;尤为重要的是TGNs浓度低的患儿,更具有疾病复发的危险性。以PCR为基础的方法来鉴别TPMT的突变,确定其基因型,其结果与检测红细胞中的TPMT活性所确定的TPMT的表型之间具有98%的一致性。除天生TPMT缺失者在服用常规剂量嘌呤类药物具有致命血液毒性外,最近研究表明,由于在TPMT基因位点上杂合性而造成TPMT中等活性的病人也具有发生嘌呤类药物血液毒性的高危险性。为了确定6-MP的适宜剂量,在用6-MP治疗的急性白血病患儿中,应监测红细胞中TGNs水平或TPMT的表型和基因型。
由于TPMT基因型和表型的相关性良好,可以通过检测基因型预测表型:杂合子个体TPMT活性中等,TPMT突变基因纯合子个体活性缺乏。此外,带有两种突变基因的纯合子TPMT*2/TPMT*3A和TPMT*3A/TPMT*3C个体酶活性缺乏。TPMT *2、TPMT*3A和TPMT *3C代表了不同人种80-95%的基因突变类型,所以目前的基因型检测主要针对这几种突变。TPMT*2的测定主要采用等位基因特异性的PCR扩增方法(allele-specific PCR),TPMT*3B和TPMT*3C的测定主要采用PCR扩增后限制性片段长度多态性分析方法(restriction fragment length polymorphism,PCR-RFLP )。需要指出一种特殊情况,采用基因型检测法无法区分杂合子TPMT*1/TPMT*3A(活性中等)和突变基因纯合子TPMT*3B/TPMT*3C(活性缺乏),这种情况需要同时采用活性检测法和基因型检测法确诊。
已经发现细胞内硫鸟嘌呤的浓度与TPMT的活性成负相关。缺乏野生型TPMT并具有高浓度变异体TPMT的病人能累积高浓度的硫鸟嘌呤代谢物而导致致死性的骨髓毒性。具有中等活性TPMT活性的病人,较少积累硫鸟嘌呤核苷,但与具有正常TPMT活性的病人相比,这些病人仍然有较高的发生骨髓和其他毒性的危险。因而,约有10%的病人用硝基咪唑硫嘌呤治疗时发生硝基咪唑硫嘌呤诱导的骨髓毒性的危险增加。在治疗前如果医生了解病人TPMT的状态,这种危险是可以减小或避免的。相反,如果病人的TPMT活性很高,则可能对硫嘌呤类药物没有响应,因为它们很快就从人体被清除掉了(图5)。
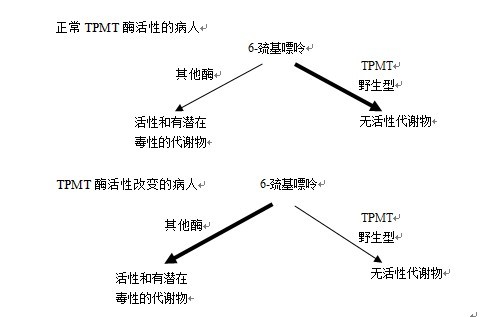
图5 正常TPMT酶活性的病人和TPMT酶活性改变的病人的6-MP代谢情况比较
TPMT是存在于哺乳动物和禽类细胞中的一种非金属依赖性酶,能利用S-腺苷-L-甲硫氨酸(SAM)作为甲基的供体和底物结合,特异地催化杂环类和芳香类化合物苯环6-位硫原子的甲基化。该酶在嘌呤类药物的抗白血病作用中起关键作用,其DNA编码序列上的核苷酸突变是造成此类药物不同强度的细胞毒作用的基础。
TPMT广泛分布于人体的各大组织和器官,如肝脏、肾脏、胃肠道、肺、脑、血液,以及胎盘等。成年人肝细胞的TPMT浓度和血液组织中的TPMT浓度几乎呈直线相关。TPMT的浓度及活性在人体各组织内、甚至肿瘤组织中均存在密切相关性,测定红细胞中的TPMT浓度即可大致估计其他组织的酶活性。
TPMT是嘌呤类药物代谢过程中决定巯基鸟嘌呤核甘酸(TGNs)浓度的关键酶。6-巯基嘌呤(mercaptopurine,6-MP),一种嘌呤类抗癌药物,在体内可以转化成TGNs,后者在DNA合成中整合到肿瘤细胞DNA和RNA分子中,影响DNA的复制及RNA的表达而发挥抗肿瘤作用,但过多的TGNs将导致严重的毒副作用。临床上给予标准剂量的嘌呤类药物治疗时,部分患者发生严重的造血毒性反应,这种对药物的不耐受现象提示可能存在TPMT活性缺陷。对此类患者的研究表明,其中绝大多数患者存在遗传性TPMT活性降低或缺失,因而导致对药物毒性的敏感性增加,造成骨髓抑制和肝细胞损害等。如果用药之前对患者的TPMT酶活性进行测定,可以预测并避免或减少毒性反应的发生,而通过TPMT基因分型检测是预测TPMT酶活性的有效措施。
相关药物介绍
嘌呤类抗癌药物如6-巯基嘌呤(6-MP)、6-巯鸟嘌呤(6-TG)及免疫抑制药物硫唑嘌呤(AZA)均为无活性的药物前体,在体内需经过一系列的代谢过程生成巯基鸟嘌呤磷酸盐(TGNs)方能发挥其细胞毒性作用。临床上常作为急性白血病化疗、器官移植及自身免疫性疾病治疗的免疫抑制剂,如6-MP用于儿童急性白血病的维持治疗,AZA用于治疗类风湿性关节炎和克罗恩(Crohn)病等。
嘌呤类药物属于抑制嘌呤合成途径的细胞周期特异性药物,化学结构与次黄嘌呤相似(图1),因而能竞争性地抑制次黄嘌呤的转变过程。这里主要介绍6-MP。6-MP是腺嘌呤6位上的-NH2被-SH取代的衍生物。在体内先经过酶的催化变成硫基次黄嘌呤单磷酸盐(TIMP)后,阻止肌苷酸转变为腺核苷酸及鸟核苷酸,干扰嘌呤代谢,阻碍核酸合成,对S期细胞作用最为显著,对G1期有延缓作用。肿瘤细胞对6-MP产生耐药性是由于耐药细胞中6-MP不易转变成TIMP或产生后迅速降解。6-MP起效慢,主要用于急性淋巴细胞白血病的维持治疗,大剂量对绒毛膜上皮癌亦有较好疗效。常见骨髓抑制和消化道粘膜损害,少数患者可出现黄疸和肝功能损伤。

图1 次黄嘌呤(左)、6-巯基嘌呤(中)和腺嘌呤(右)化学结构图基因结构
TPMT全称为thiopurine S-methyltransferase,中文名为硫嘌呤甲基转移酶。TPMT基因位于染色体的6p22.3位置,全长26,832bp,共有11个外显子,mRNA长3,258nt,编码由245个氨基酸残基组成的蛋白质。
基因分子生物学功能
TPMT是一种非金属依赖性酶,以S-腺苷-L-甲硫氨酸(SAM)作为甲基的供体,特异地催化杂环类和芳香类化合物苯环6-位硫原子的甲基化,起到甲基转移的作用。正因为如此,TPMT在硫嘌呤类药物的体内代谢中起着重要作用。硫嘌呤类药物在临床上用于急性白血病和一些自身免疫疾病的治疗,TPMT的活性与这类药物的临床疗效和毒性密切相关。
6-巯基嘌呤(6-MP)和硫鸟嘌呤(6-TG)是众多抗白血病药物中使用最广泛的两种药。6-M P和6-TG均为无活性的前体药,需在体内经代谢生成巯基鸟嘌呤核甘酸(Thioguaine nuclectides,TGNs) 后才能产生细胞毒性。另外,这两种药物可被TPMT催化发生甲基化反应或者经黄嘌呤氧化酶(Xanthineoxidase)催化成硫脲酸,这两种途径来减少TGNs。然而在造血系统、组织中黄嘌呤氧化酶的活性极低,从而使TPMT催化的甲基化反应成为TGNs主要的代谢途径。
参与的通路
TPMT能利用S-腺苷-L-甲硫氨酸(SAM)作为甲基的供体和底物结合,特异地催化杂环类和芳香类化合物苯环6-位硫原子的甲基化,因此它在硫嘌呤类药物的体内代谢中起着重要作用。硫嘌呤类药物在临床上用于急性白血病和一些自身免疫疾病的治疗,TPMT的活性与这类药物的临床疗效和毒性密切相关。现以TPMT参与6-MP代谢通路(图2)来了解其生物学功能,以及在药物代谢过程中所处的重要地位。

图2 6-MP代谢通路简图
6-MP的代谢途径:①由次黄嘌呤磷酸核糖转移酶(HPRT)催化形成硫基次黄嘌呤单磷酸盐(TIMP)、硫基黄嘌呤单磷酸盐(TXMP)、硫基鸟嘌呤单磷酸盐(TGMP),后者经磷酸化后分别形成二磷酸盐和三磷酸盐。后三种物质统称为TGNs,它整合到肿瘤细胞中影响DNA的复制及RNA的表达,发挥抗肿瘤作用。②6-MP、TIMP、TGMP均可由TPMT催化生成甲基化的衍生物6-meMP、6-meTGMP、6-meTIMP,这些甲基化的化合物属于“无活性”的物质,它们能够抑制磷酸核糖焦磷酸化氨基转移酶(PRPP-AT)的活性,后者是细胞重新合成嘌呤步骤中的关键酶,因此,抑制PRPP-AT的活性就阻断了肿瘤细胞遗传信息的表达,从而达到抗白血病的作用。③由黄嘌呤氧化酶催化形成6-硫基黄嘌呤后再形成尿酸,也可直接生成尿酸排出。
基因对药效的影响
TPMT基因具有遗传多态性,并与酶活性密切相关,表现为常染色体共显性遗传特征(图3)。大约89%的人的TPMT酶活性>6U/ml pRBC,属于高活性;而11%的人的TPMT酶活性为1-5U/ml pRBC,属于中度活性;大约1/300的人的TPMT酶活性<1U/ml pRBC或无法测出,属于低活性。11%有中度活性的人是杂合子,TPMT缺陷的个体是低活性等位基因的纯合子。在使用6-MP时,TPMT的低活性将导致形成高浓度的TGNs,引起明显的造血组织细病毒性,产生严重后果,甚至引起死亡。

图3 TPMT遗传多态性与其酶活性的关系示意图

图4 TPMT基因点突变示意图
通过对TPMT缺陷或中等活性个体作基因型-表型分析(genotype-phenotype analysis),发现在TPMT基因的编码区有多种点突变,这些数量有限的点突变构成了TPMT遗传多态性的分子基础。目前,至少有10种点突变类型可以引起TPMT活性改变,它们是TPMT*2、3A、3B、3C、3D和4-8(图4)。而至2006年为止TPMT的SNP总数达到了23个(TPMT*2-*22)[1]。野生型TPMT基因被定义为TPMT*1。按照突变与否来分类,TPMT的基因型可分为野生型基因纯合子(wt/wt)、杂合子(wt/mut)和突变基因纯合子(mut/mut)三种类型。TPMT*2是最早发现的点突变,在外显子5中发生单碱基突变G238C,导致TPMT酶第80位氨基酸改变(Ala→Pro),在酵母中进行表达发现TPMT酶活性下降了100倍[2]。第二个被发现的点突变类型是TPMT*3A,在外显子7和9(过去文献中报道为10)中分别发生单碱基突变G460A和A719G,分别导致TPMT第154位氨基酸改变(Ala→Thr)和第240位氨基酸改变(Tyr→Cys),在酵母中进行表达几乎没有活性。TPMT*3B仅有G460A突变,该突变使MwoI的酶切位点消失。TPMT*3C仅有A7I9G突变,该突变产生了一个Accl的酶切位点。随后其他的点突变类型陆续被发现,但这些突变都非常罕见。
治疗TPMT缺失的病人时,6-MP的剂量要减至常规剂量的6%-10%,以防止出现致命的血液毒性。与此相反,具有高活性TPMT的纯合者会对6-MP治疗产生抗药性。由于红细胞中TPMT的活性与白细胞、肝、肾、及白血病幼稚淋巴细胞中TPMT的活性具有良好的相关性,因此临床上通过检测红细胞中TPMT活性来反映体内其他组织中的TPMT活性。TPMT活性与红细胞中的TGNs浓度呈负相关。与红细胞中TGNs浓度大大超过人群平均值者相比,红细胞TGNs水平较低者的TPMT活性明显升高;尤为重要的是TGNs浓度低的患儿,更具有疾病复发的危险性。以PCR为基础的方法来鉴别TPMT的突变,确定其基因型,其结果与检测红细胞中的TPMT活性所确定的TPMT的表型之间具有98%的一致性。除天生TPMT缺失者在服用常规剂量嘌呤类药物具有致命血液毒性外,最近研究表明,由于在TPMT基因位点上杂合性而造成TPMT中等活性的病人也具有发生嘌呤类药物血液毒性的高危险性。为了确定6-MP的适宜剂量,在用6-MP治疗的急性白血病患儿中,应监测红细胞中TGNs水平或TPMT的表型和基因型。
由于TPMT基因型和表型的相关性良好,可以通过检测基因型预测表型:杂合子个体TPMT活性中等,TPMT突变基因纯合子个体活性缺乏。此外,带有两种突变基因的纯合子TPMT*2/TPMT*3A和TPMT*3A/TPMT*3C个体酶活性缺乏。TPMT *2、TPMT*3A和TPMT *3C代表了不同人种80-95%的基因突变类型,所以目前的基因型检测主要针对这几种突变。TPMT*2的测定主要采用等位基因特异性的PCR扩增方法(allele-specific PCR),TPMT*3B和TPMT*3C的测定主要采用PCR扩增后限制性片段长度多态性分析方法(restriction fragment length polymorphism,PCR-RFLP )。需要指出一种特殊情况,采用基因型检测法无法区分杂合子TPMT*1/TPMT*3A(活性中等)和突变基因纯合子TPMT*3B/TPMT*3C(活性缺乏),这种情况需要同时采用活性检测法和基因型检测法确诊。
已经发现细胞内硫鸟嘌呤的浓度与TPMT的活性成负相关。缺乏野生型TPMT并具有高浓度变异体TPMT的病人能累积高浓度的硫鸟嘌呤代谢物而导致致死性的骨髓毒性。具有中等活性TPMT活性的病人,较少积累硫鸟嘌呤核苷,但与具有正常TPMT活性的病人相比,这些病人仍然有较高的发生骨髓和其他毒性的危险。因而,约有10%的病人用硝基咪唑硫嘌呤治疗时发生硝基咪唑硫嘌呤诱导的骨髓毒性的危险增加。在治疗前如果医生了解病人TPMT的状态,这种危险是可以减小或避免的。相反,如果病人的TPMT活性很高,则可能对硫嘌呤类药物没有响应,因为它们很快就从人体被清除掉了(图5)。

图5 正常TPMT酶活性的病人和TPMT酶活性改变的病人的6-MP代谢情况比较
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发