卡脖子!mRNA疫苗质量控制中不可缺少的关键原料!
| 导读 | 2021年2月24日,《MIT Technology Review》发布了“全球十大突破性技术”名单,其中榜首即是mRNA疫苗。 |

全球十大突破性技术榜首--mRNA疫苗
2021年2月24日,《MIT Technology Review》发布了“全球十大突破性技术”名单,其中榜首即是mRNA疫苗。从2019年12月新冠爆发到2022年4月1号,全球新冠确诊已超4.8亿。新冠病毒的蔓延促进了mRNA疫苗的发展。mRNA疫苗在新冠疫苗开发方面的成功,也促进了其在各种传染病与肿瘤等治疗方面广阔的应用前景。
mRNA疫苗的生产流程包括序列设计、mRNA体外转录、体外修饰(加帽、加尾)、脂质体包被等过程。2020年发布的《预防用新型冠状病毒mRNA疫苗药学研究技术指导原则》中对mRNA的质量提出了一系列的要求,加帽率和加尾长度是其中最关键的2个指标。5’cap (5’帽)结构是翻译起始所必须的结构,为核糖体识别mRNA提供信号,并协助核糖体与mRNA结合使翻译从起始密码子开始。3’poly(A)(3’尾)可以控制mRNA的稳定性,以防降解,所以在mRNA合成修饰过程中,需要对5’加帽效率和3’poly(A)尾的分布进行监控。

图.1 mRNA的结构可以分为5个部分,包含5’cap,5’UTR,ORF,3’UTR和3’polyA。
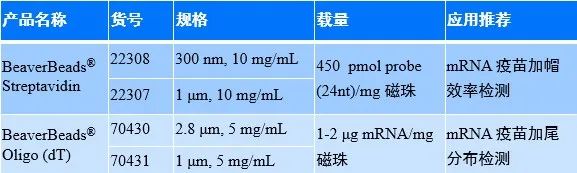
疫苗mRNA因为长度较大,为几千个核苷酸,而无法直接进行检测,因此需要将5’ cap和3’ poly(A)端酶切成短片段,酶切之后5’ cap和3’ poly(A)均可以通过纳米磁珠进行高通量、快速分离,这种纳米磁珠通常粒径在1-3μm之间。

3’ PolyA尾的检测方法与5’加帽效率的检测方法类似,需要通过酶切的方式获得3’端的Poly A尾短链,然后利用Oligo dT磁珠分离纯化,再分别进行毛细管电泳或质谱准确分析其长度分布(图3)。

图3. 3’ Poly(A)尾分布的检测流程
在mRNA的5’端加帽效率和3’加尾分布的检测过程中,都需要磁珠进行mRNA片段的富集。磁珠的性能影响到整个检测数据的准确性和可靠性,该过程中的磁珠一般需要如下的特征:
a) 非特异性吸附低;
b) 灵敏度高,磁珠表面具有丰富的结合位点;
c) RNA易洗脱,磁珠表面需要特殊的封闭;

海狸生物创立于2011年,位于苏州工业园区,场地面积超过12000㎡。专注于纳米磁珠技术的研发和产业化,为体外诊断、生物制药、动物疫病检测、环境检测、食品药品安全检测、生物科研、等领域,提供纳米磁珠原料、蛋白偶联中间体、免疫标记与捕获磁珠、核酸提取磁珠及试剂盒、真菌毒素净化试剂盒等产品,并辅助自动化设备及配套的生物耗材。拥有ISO9001和ISO13485国际质量管理体系认证,部分产品获得I类医疗器械备案。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发