【深度分析】造福更多不孕患者来日可期:PGT-A的现状与未来
| 导读 | 2021年11月25日,全球顶尖的医学科学期刊《新英格兰医学杂志》(NEJM)发表了山东大学附属生殖医院陈子江院士领衔的一项大样本、多中心、随机对照临床试验的科研成果。 |

2021年11月25日,全球顶尖的医学科学期刊《新英格兰医学杂志》(NEJM)发表了山东大学附属生殖医院陈子江院士领衔的一项大样本、多中心、随机对照临床试验的科研成果。该试验比较了接受常规体外受精(IVF)与接受“第三代”试管婴儿非整倍体检测(PGT-A)患者的临床结局。研究结果发现,在一年内期限内,最多三次植入单个囊胚的情况下,IVF常规形态学评估患者组的累计活产率为81.8%,接受PGT-A检测患者组的累计活产率为77.2%。这个数据结果提示着,冒着胚胎活检的风险,付出昂贵的单精子注射(ICSI)与分子检测代价,那些接受“第三代”试管婴儿PGT-A检测的患者,他们最终的妊娠成功率并不高于接受“第一代”试管婴儿治疗的患者。从累计活产率数字看,甚至还低了4.6个百分点(虽然并不存在统计学差异)。辅助生殖行业本来就对PGT-A的临床获益效能存在意见分歧。有一批学者与医生甚至成立了一个松散的学术组织,叫“The International Do No Harm Group in IVF (IDNHG-IVF)”,联合起来反对PGT-A。这一研究结果的发表,对这一争议可谓是“火上浇油”。
PGT-A技术的“进化论”,从1.0走向未来!
PGT-A的曾用名叫PGS,早期的PGS是用免疫荧光杂交检测(FISH)方法实施的。FISH是一种低通量检测方法,检测前必须要指定目标染色体。因为荧光染料颜色数目的限制,即使把前次检测的荧光信号漂白,然后对同一样本再做一次检测,基于FISH技术的PGS最多也就检测5、6条染色体,远远无法全面覆盖人类的22对常染色体和两条性染色体。那么,基于FISH的胚胎植入前非整倍体检测能否改善、提高试管婴儿患者的妊娠成功率?经历20余年的艰苦摸索,N多临床研究之后,得出的是令人失望的否定答案。进入新世纪后的第二个10年,高通量分子检测技术获得了蓬勃发展,与单细胞全基因组扩增技术的突破性改进(比如MALBAC技术)相结合,高通量DNA芯片、高通量测序(NGS)方法开始应用于PGS。高通量分子检测技术可以一次性对胚胎的全部染色体进行整倍体检测筛查,除了整染色体的拷贝数异常外,甚至可以检出染色体局部片段的拷贝数异常,与传统的FISH检测相比,极大地提高了检测效能,因而被称作“PGS2.0”。但是,“PGS1.0”无法在提高试管婴儿成功率方面使患者临床获益的“阴影”尚在人们心头挥之不去。这个“PGS2.0”虽然在技术指标上先进了许多,但真的就能改善不孕不育患者接受试管婴儿治疗的妊娠成功率么?临床医生们当然不敢轻信。
回答这个问题只能靠临床研究。近十年来,越来越多的临床研究表明,高通量方式的“PGS2.0”,现在叫PGT-A,可以在试管婴儿妊娠结局方面使患者临床获益。比如,三项随机对照试验的Meta分析结果显示,与依据形态学进行胚胎选择对比,PGS2.0获得了更高的临床妊娠率、持续妊娠率和活产率,降低了流产率,同时缩短了妊娠所需时间。八项观察性研究的Meta分析结果也表明,与常规IVF相比,PGS2.0的临床妊娠率和持续妊娠率均有所提高。那么问题来了,难道最近这篇在全球最顶级医学期刊上发表的,由院士团队领衔的多中心、随机对照临床研究所得出的结果与上述其它研究结果相矛盾么?其实并非如此。那么,我们应该如何理解这一研究结果与先前他人研究结果的关系呢?简单来说,这项研究与先前那些研究的观察角度略有不同, 这一研究阐释了试管婴儿这个复杂问题的另一个方面。
一项医疗技术的临床获益评估并非是黑的或白的那么简单,而是条件性,多维度的。从不同视角去观察,经常会看到不同的效果。长期、多角度的临床观察研究正是为了使我们对这项医疗技术的理解更加深入、完善。只有经过全面、完善、多视角、多维度的研究才能找到这项医疗技术最闪亮的临床获益点,找到其最佳适应症,使最恰当的患者群在其最需要的方面获益。并且,即使当前的技术水平还不够理想,还不能在所有维度使患者获益,从多角度的观察研究之中我们也可以找到技术改进的努力方向,以增加获益、减少损害,兴利除弊,这正是科技创新的必由之路。院士团队这篇高水平的研究工作从一个新的视角观察了PGT-A的临床效能。咱们深入分析其结果数据,与他人先前的研究结果相印证,正可以起到指明PGT-A发展方向的作用。笔者不揣浅陋,在此愿与各位读者一起对这项工作中所获得的各项数据做一点比较深入的分析与探究。希望借此可以找到PGT-A未来的发展道路。
PGT-A成功为若干特定患者人群解决不孕不育问题!
首先需要注意的是,这项研究所纳入的患者人群是“符合IVF指征的20~37岁不孕症患者”,与当前临床常规的PGT-A适应症并不相同。当前常规的PGT-A临床适应症是:
- 女方年龄38岁及以上
- 不明原因反复自然流产2次及以上
- 不明原因反复种植失败3次以上
- 严重畸精子症
相应地,从文中数据可见,这群患者在促排卵后的获卵数较多(平均20个),形态学优质囊胚较多(平均7个以上),整倍体胚胎占比较高(达69.8%, 一般为50-60%)。从文章的补充数据中可以看到,这批患者的临床结局也远好于普遍的IVF人群。其按胚胎形态学移植的对照组,在单胚移植的情况下,首次移植的活产率即达62.1%,远高于临床常见的40%左右。
第二需要注意的是,该研究的主要临床观察终点指标是一年内、三次、单个胚胎移植的累计活产率。这个临床疗效指标在先前的其它研究中也有用到,但经常是作为次要指标来考察。为了减少研究周期,最常用的主要观察终点指标是首次移植的持续妊娠率。即使用活产率作为临床效能研究的主要指标,也是观察首次移植的活产率。“首次”与“多次累计”之差异,正是试管婴儿这项医疗技术的独有特点。
得益于促排卵技术,在试管婴儿治疗中,女性患者接受一次促排可以获得多个卵子,受精成为胚胎后即可获得多次植入机会。不论其中多少胚胎是“坏”的,只要存在一个“好”的,无需任何检测,坚持一个个地植下去,早晚会轮到那个“好”的。此时只要患者子宫内膜没问题,怀孕就会成功。而另一方面,无论应用什么检测技术,其所能达成的最优效果,无非就是把那个“好”的挑出来,最先植进去,尽早受孕。可如果该患者从这个促排周期中一个“好”卵都没得到,再好的检测技术也无力回天。所以,理论上讲,检测与不检测,累计妊娠成功率不会存在差别。PGT-A检测可以预期达成的临床获益是“快”,使患者尽早地成功妊娠。
PGT-A让患者更“快”获益!
“快”这个临床获益首先体现在时间上,但其意义绝不仅仅是时间。从患者角度而言,一次又一次地胚胎植入失败、早期流产的心理煎熬、健康损害是旁人无法体会的。临床医生一次又一次地胚胎解冻复苏、培养、移植手术都是不小的工作量。并且这些工作量都会转化成为患者的医疗经济负担。“快”起来,这些损害与负担都会减小,对所有人,对全社会都有益处。那么,在“快”的方面,院士团队的研究结果与先前他人的研究结果相比又如何呢?先前他人研究中常用的观察指标,首次植入活产率,在该研究中并未被列入观察指标,因此在论文正文中无法见到。笔者从论文的补充资料中把这些数据找了出来,按研究的实施过程画了个拓扑图(见下图),从中发现了更多的信息。
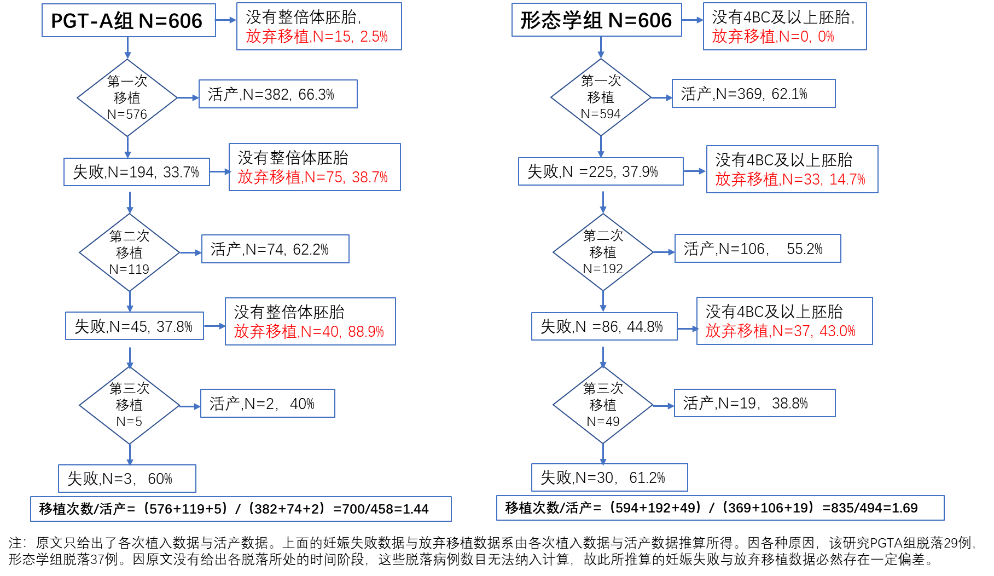
正如前文所述,此研究中的患者人群并非当前临床的PGT-A适应症人群,而是“亚PGT-A适应症”人群。她们的胚胎中发生染色体非整倍体的概率低于PGT-A适应症人群。也就是说, 她们的 “好”胚概率比PGT-A适应症人群要高。在不做染色体检测的情况下,这群患者中最终妊娠成功的幸运者,她们的幸运会比PGT-A适应症人群依据形态学植入而妊娠成功者的幸运来得更“快”。换句话说,对PGT-A适应症患者,如果依据形态学植入,她们即使妊娠成功,会比该研究中的形态学组患者成功得更慢。那么,在这些“亚PGT-A适应症”患者中我们都可以观察到PGT-A组的妊娠患者比形态学组实现得更“快”。我们可以合理推测, 在PGT-A适应症人群中做与不做PGT-A检测,妊娠成功的快慢差异会比该研究在“亚PGT-A适应症”患者中所展示出的差异更加显著。这与先前诸多的PGT-A临床研究结果正相一致。
PGT-A的高“弃植率”,加速患者达孕的同时是否也意味着更多“浪费”!
该研究限定了每位患者最多只能接受三次胚胎植入。在对比了PGT-A组与形态学组每次植入的成功率后,或许会有读者感到奇怪:在三次胚胎植入中的每一次,PGT-A组的活产率都高于形态学组。可怎么这三次植入的累计活产率,PGT-A组却低于形态学组(77.2% vs 81.8%)?!没算错吧?反复检查了,没算错。仔细观察计算过程才发现其中奥妙。每次植入后的活产率与累计活产率计算,它们的分子都是婴儿活产数,是一个“分项之和等于总项”的关系。可它们的分母就不同了。三次接受植入患者的总和数并不等于纳入研究的患者总数,而是小于。就是说,有些患者在第一次植入失败后并没有接受第二次植入,而是放弃继续植入了。第二次植入失败的患者也并没有都接受第三次植入,又有一部分人放弃植入了。在分别计算两组的累计活产率时,分母中是包括了这些放弃植入的患者的。而在计算每次植入后的活产率时则无法包括这些患者。PGT-A组三次植入后每一次的活产率都比形态学组高,而最后的累计活产率却比形态学组低。这提示着,PGT-A组有更高比例的患者,即使在前一次植入后得不到成功妊娠也无法接受下一次植入,只能放弃!
该研究并没有给出每个阶段放弃植入的患者人数。笔者只好用每次接受植入的人数、每次植入获得的活产数,和接受下一次植入的人数做了一个推算,其结果所展示的信息量还真有点大!(上面拓扑图中红字部分)
不算不知道,一算吓一跳!在形态学组,第一次与第二次植入之间,第二次与第三次植入之间的“弃植率”分别为14.7%和43%。而在PGT-A组,这两个阶段的“弃植率”则高达38.7%和88.9%!高“弃植率”,正是PGT-A检测使这批患者在“快”的方面小有获益,却在最终成功机会(累计活产率)方面受损的根本原因!
为什么会有患者放弃植入?在形态学组是因为患者没有了4BC或以上级别的胚胎。在PGT-A组是因为没有了整倍体胚胎(该研究设定,不植入嵌合胚胎)。须知任何检测判断都是会存在假阳性的,形态学判断、PGT-A检测都不会例外。不论依据形态学判断还是PGT-A检测,遭到假阳性判断的胚胎,其结局就是被放弃、被“冤杀”、被浪费。从该研究的结果数据来看,在累计成功率没有统计学差异的情况下,在每次植入时,PGT-A组的“弃植率”都高达形态学组的两倍以上!这说明PGT-A检测的假阳性率远较形态学判断为高!所以,在同等时间内(一年),PGT-A组患者中获得成功妊娠的人,其成功来得比形态学组中的成功者更快,但PGT-A并没有使获得成功的人更多,因为PGT-A组的胚胎浪费率更高!
胚胎浪费!这正是前述IDNHG-IVF组织中的学者、医生们对PGT-A持反对态度的关键所在!他们认可PGT-A检测可以使成功者的成功来得更快,这确实是患者、医生和全社会都受益的。但他们同时质疑PGT-A(与形态学判断相比较)较高的假阳性率使更多的患者浪费了她们的胚胎,陷入“无胚可植”尴尬境地,失去了成功的机会!与简单、廉价的形态学判断相比,冒着胚胎活检风险、付出更高经济代价的PGT-A检测对她们不仅无益,反而有害!院士团队的这项研究结果正是从这个角度支持了PGT-A反对者们的质疑。同时,从同样的数据,经过深度分析,我们也可以看到,这项研究结果同样支持PGT-A赞同者们的正面观点。一件事情从不同的角度去看,各有利弊而已
当前的PGT-A技术远非完美,造福更多患者,路在何方?
至此,通过对院士团队这项研究数据的深入分析,我们可以发现,PGT-A既不是天使,也不是魔鬼,而是既有天使的一面,也有魔鬼的一面,是一个综合体。其实世间万物大抵如此,这并不意外。我们需要做的是趋利避害,小心选择。具体而言,这项研究告诉我们,“亚PGT-A适应症”患者并不适于接受当前的PGT-A检测。把现有的PGT-A检测泛化到所有IVF患者是不恰当的。严格掌握PGT-A检测的临床适应症,使真正获益概率最高的患者接受这项检测才是正确的做法。
当前的PGT-A检测远非完美,应当怎样改进才可以扬长避短,兴利除弊,使其更好地服务于患者,使更多的患者切实受益,而避免对患者的利益损害呢?笔者不才,愿意借这个机会,结合自身的工作经验和感悟与各位读者做一点探讨。胚胎非整倍体检测的假阳性比形态学判断为高,从测量学上来看,这说明PGT-A检测对胚胎“好”、“坏”的判定标准比形态学判断更加严格。如果可以调整这个判定标准的严格度,使其与形态学判断等同,换句话说,使PGT-A组的“弃植率”降低到与形态学组的同等水平,理论上就可以达成在患者接受检测后,成功者的成功来得更快,同时不伤害任何患者的成功机会,使所有患者的成功机会都不低于形态学判断方法。这才是PGT-A的理想效果。
不幸,这个思路在常规的临床检验概念框架下是无法实现的。首先,PGT-A检测假阳性结果的来源有一个深层次的生物学原因:胚胎的自修复现象。PGT-A检测的是在一个时点上(胚胎体外培养第5天)胚胎染色体的数目状态。而当前越来越多的研究表明,胚胎在成长发育过程中,其中的染色体异常细胞可以更倾向于死亡、淘汰。正常细胞则持续繁殖,当异常细胞死亡殆尽时就实现了胚胎的自我修复,成功发育成胎儿。而哪些、什么样、什么程度的染色体异常可以在胚胎发育中自我修复,目前尚不得而知。其次,当前临床检验的常规概念,是对检测对象做一个两分法判断,通常是:阴性-正常与阳性-异常。为实现这种“非黑即白“式的两分法判断,在检测的方法学建立过程中必须要设定一个判断阈值或阈值范围。当检测结果符合阈值或阈值范围时就判断为阴性-正常,偏离阈值或超出阈值范围就判定是阳性-异常。在PGT-A检测而言,这个阈值就是染色体的拷贝数。正常的常染色体都是两拷贝,检测结果是两拷贝就判定为阴性-正常,偏离了两拷贝就判定为阳性-异常。阴性-正常的胚胎可以植入,阳性-异常的胚胎不可以植入,这就是黑白两分,没啥可商量的。
PGT-A检测采用这种两分法判定逻辑,注定无法应对胚胎自修复这个生物学现象。在胚胎检测时按拷贝数阈值判定的阳性-异常并没有错,是真阳性。但胚胎可能在后续发育中修复,检测结果就成了假阳性。这是个解不开的死结!理想的PGT-A检测不应是一个“非黑即白“的判断,而应该对“不那么正常”的胚胎的自修复有个评估、预测功能。即使无法做到100%地准确预测,做出概率性的评估也好。我们就可以按胚胎成功发育的概率给某患者的全部胚胎做一个排序。然后按顺序一个一个地植入。这样就可以最大化地利用患者的全部胚胎,一个都不浪费,获得最高的累计成功率,同时使患者的成功在最快的速度下实现。
获益与风险的平衡,无创胚胎移植潜能筛查(NICS)或是更优选择!
胚胎发育潜能排序,这是个突破临床检验常规概念的思路。按照这个思路开发临床诊断产品,获得普遍的接受、认可,特别是获得政府的医疗行政监管部门的接受与认可,可能没那么容易,还需要一定时间。可喜的是,已经有临床科研和产品研发人员在这个思路上迈出了第一步。刚刚在Reproductive BioMedicine Online上发表的一篇题为《Non-invasive embryo selection strategy for clinical in vitro fertilization treatment to avoid wastage of potentially qualified embryos》的研究工作,正是针对胚胎浪费问题,按上面胚胎发育潜能概率评估预测的思路,通过人工智能(AI)、机器学习的方法做出了解决方案,展示了优良的效果。并且,笔者得知,正在由北医三院乔杰院士牵头,十余家临床中心参与的一项大样本、多中心、随机对照的无创胚胎检测的临床研究已经进展过半,该研究中即采用了相同的胚胎评级思路与方法,其良好效果可期!细心的读者可能会发现,笔者上面提到的两项研究并非常规的,依赖胚胎活检的PGT-A,而是基于胚胎体外培养液检测的无创胚胎检测方法。是的,新概念的胚胎发育潜能AI评估分级方法正是基于这个无创检测实验方法(NICS)实现的。PGT-A胚胎活检的创伤性,一直也是PGT-A反对者们的重要理由之一。那个反PGT-A组织,“The International Do No Harm Group in IVF (IDNHG-IVF)”,其名称中的“Harm”指的就是活检带来的胚胎伤害。
任何医疗技术的实施,其伦理前提都是给患者带来的临床获益要大于给患者带来的风险和代价,而不能反过来。如本文的前半部分所述,当前的PGT-A技术可以给其适应症患者带来尽快受孕成功的益处。但一旦检测适应症掌握不当,也可能给某些患者代来胚胎浪费的风险。并且,胚胎活检的风险是当前所有接受PGT-A检测的患者所必须承受的。整体平衡下来,获益与风险孰重孰轻,确实需要慎重考虑。至少,前面院士团队论文中所研究的患者人群,“亚PGT-A适应症”的IVF患者,冒着这样的风险去接受当前的PGT-A检测是大概率得不偿失的。但另一方面,从前面的数据分析讨论中可以看到,即使对这批“亚PGT-A适应症”患者,染色体检测、胚胎筛选可以使受孕者成功得更快,这个益处也是可见端倪的。如果可以消除当前PGT-A的弊端,具体而言,以胚胎发育潜能分级排序植入的方法取代非整倍体两分法判断,从而避免胚胎浪费,同时以无创的胚胎培养液检测取代胚胎活检,避免胚胎创伤风险。这样,即使“亚PGT-A适应症”人群都可以没有风险代价地从胚胎植入前染色体检测筛查中获益。所以,无创的PGT-A(niPGT-A)才是PGT-A的技术发展方向。
熟悉胚胎植入前检测技术的读者都了解,当前PGT-A技术的弊端还不止前面提到的那些。按照当前临床规范,为做PGT-A必须要采用单精子注射(ICSI)的方法对卵子进行受精。ICSI本是针对男性不孕中的少、弱精患者所不得已而采取的受精办法。越来越多的研究表明,受精过程中缺失了精子之间的自由竞争,人为地武断选取一颗精子注射入卵子,对妊娠期不良并发症的发生与后代健康都存在着一定不利影响。比如,已有研究发现,经ICSI出生的儿童,其孤独症的发病率比人群平均高出4.6倍!
那么当前做PGT-A为什么要求用ICSI方法受精呢?因为顾虑父源的多余精子与母源的颗粒细胞污染会干扰检测。因为这一顾虑,众多并非因男性少、弱精而不孕,本来无需接受ICSI受精的患者,为了要做PGT-A而做了ICSI,无端承受了母婴健康的额外风险。
胚胎活检与ICSI,除了给患者、胚胎带来短期与长期的健康风险以外,从医生与医院的角度,都是对仪器设备、耗材物资、人员操作技能要求极高的医疗技术,实施起来所费不赀。而这些耗费都无可避免地会转移到患者身上成为其医疗经济负担。
所以,畅想未来,真正完美的胚胎植入前检测,姑且称其为IVF-niPGTA,它无需ICSI - IVF受精就可以;无需胚胎活检 - 以胚胎培养液为活检样本;不是按染色体拷贝数阈值对胚胎做正常与异常的两分法判断 – 而是对检测结果进行AI评估,按照其发育潜能的概率大小进行分级排序。这个IVF-niPGTA对IVF患者有百利而无一害,远不是今天的PGT-A可以同日而语!
咱们离这个美好理想还有多远?前面提到,无创检测与胚胎评估分级在技术上已经实现,科研论文已经发表,正在进行大规模的临床试验研究,并且,应用这一技术的体外诊断产品已经顺利通过国家注册检验,未来应用已经前景可期。避免ICSI,实现IVF受精的无创胚胎检测,技术上需要克服父源精子污染与母源颗粒细胞污染的难题。据笔者了解,对精子污染的克服当前已经有了解决方案。通过培养液全基因组扩增前的差异化裂解就可以实现只扩增胚胎游离DNA,而避免精子DNA的扩增,从而避免了精子DNA对检测的干扰。相关的研究工作已经完成,科研论文正在发表之中。
母源颗粒细胞污染的克服比较困难。颗粒细胞是IVF受精所必须的辅助因子。精子的顶体反应要靠颗粒细胞才能激活,然后才能钻透卵子的透明带,进入卵子。所以在IVF受精时,在卵子的周围必须保留较多的颗粒细胞。即使在体外培养三天并换液后,培养液中颗粒细胞DNA污染的风险还会比较高。因此,必须建立一种可靠的技术手段,对培养液中来自胚胎的DNA与来自颗粒细胞的DNA进行有效区分,进而选择性地排除掉母源DNA的检测信号,只使用胚胎来源的检测信号进行胚胎染色体评估。这个技术路线从原理上可行,具体技术方案还在摸索、建立之中。请大家保持关注,拭目以待。
路漫漫其修远兮,PGT-A仍将上下而求索,造福不孕患者兮,来日可期!
一项技术创新从萌芽出现到广泛应用,造福人类,从来无法一蹴而就,而必然是一个逐渐发展、完善的曲折过程。从PGS1.0,PGS2.0,到现在的PGT-A,新突破的niPGT-A,未来的IVF-niPGTA……,胚胎植入前染色体筛查检测技术的发展正在展现着这样一个过程。在这个过程中,每个阶段的技术水平都有这样那样的不完美甚至缺陷。对此我们不应因噎废食,而应该小心谨慎地以抽丝剥茧、拂尘见金的态度去寻找其最佳应用,并针对性地弥补、改进其弱点、缺陷,最终将其打磨成为保卫人类健康的完美工具。惟其如此,才不负我辈科技人员的社会使命。本文来源:笔名老败投稿,资深行业专家,原复旦大学上海医学院副教授;
转化医学网旨在传递更多信息,文中观点不代表转化医学网立场。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发