【Int J Biol Sci重磅】中科院杨武林团队发现脂肪肝发展成肝癌的一种重要代谢调控机制
| 导读 | 由中国科学院合肥物质科学研究院研究员杨武林(音译)带领的团队最近在《International Journal of Biological Sciences 》上发表了一项重要研究,发现一种代谢调控机制可能在非酒精性脂肪性肝炎向肝肿瘤的恶性转化中发挥作用。NAFLD/NASH是肝癌发生的一个越来越重要的危险因素。近年来,饮食和生活方式的巨大变化导致全球肥胖和NAFLD的患病率不断上升。NAFLD/NASH相关肝癌的比例可能会进一步增加。然而,NASH进展为HCC的关键分子事件知之甚少,导致缺乏干预措施。在本研究中,首先分析了STAM小鼠在NAFLD进展的不同阶段的基因表达谱,并观察到控制脂质代谢的LPL/FABP4/CPT1分子轴的激活可能参与NASH向HCC的进展。 |
中国科学院合肥物质科学研究院(HFIPS)的一个研究团队报告了他们的发现,表示一种代谢调节机制可能在非酒精性脂肪性肝炎向肝肿瘤的恶性转化中发挥作用。
由研究员杨武林(音译)领导的研究团队花了两年多的时间进行这项研究,并于上月在《International Journal of Biological Sciences 》上发表了一篇题为“Targeted Inhibition of LPL/FABP4/CPT1 fatty acid metabolic axis can effectively prevent the progression of nonalcoholic steatohepatitis to liver cancer”的文章:

肝癌是全球最常见的恶性肿瘤中癌症相关死亡的第二大原因,其由具有不同组织特征和不良预后的异质性恶性肿瘤组组成。主要的肝细胞肿瘤包括肝细胞癌(HCC),肝内胆囊肿瘤(iCCA),肝癌,肝细胞腺瘤和小儿肿瘤。据估计,原发性肝癌的发病率每年在60万至80万之间,占所有人类癌症的5.6%,其中HCC约占所有原发性肝癌的80%-90%。HCC的发病率很高,并且在全球范围内趋于增加。原发性肝癌的发生,发展和转移的基本机制仍然很大程度上未知。虽然由于核苷酸疗法的应用和发展,与乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)相关的HCC患者的发病率逐渐下降,但隐源性HCC的发病率持续增加。
脂肪肝,顾名思义,是一种常见的肝脏疾病,特征是其细胞内脂肪过多积聚。有两类脂肪肝疾病,非酒精性脂肪性肝病(NAFLD)是该团队探索的一种。非酒精性脂肪性肝病逐渐占据脂肪肝的主要部分,并逐步发展,其中通常称为NASH的非酒精性脂肪性肝炎是关键阶段,因为它可能演变成肝癌。
研究人员对这个感到好奇。他们计划进行研究,以揭示非酒精性脂肪性肝炎发展为肝癌的机制。
增加食物摄入量和久坐习惯显着加剧了代谢综合征(MetS)的全球流行。据观察,MetS患者的HCC发病率高于无MetS患者。NAFLD是肝脏参与MetS背景的结果,正在成为其一部分。HCC是NAFLD最常被忽视的并发症,也可能是临床上最具挑战性的并发症。隐源性HCC的增加主要与NAFLD有关。NAFLD可从单纯性脂肪变性发展为NASH,然后发展为肝纤维化甚至肝硬化,最后发展为HCC。然而,大多数NASH进展为HCC而没有肝硬化,这表明在NASH期间可能发生促进肿瘤发生的生物过程。
相关研究表明,遗传因素、饮食和肠道微生物、促炎细胞因子TNFα和IL6与NAFLD/NASH发展为HCC有关。但是,确切的机制尚未阐明,也没有针对这些开发有效的药物。NASH被认为是NAFLD向HCC转变的关键阶段,因此揭示NASH的分子基础对于有效的疾病预防和治疗至关重要。人体标本通常仅提供疾病的某个阶段,并且很少提供关于NASH持续进展为HCC的信息。使用动物模型进行研究克服了这一局限性。
Stelic动物模型(STAM),是第一个模拟人类疾病发展的NASH相关肝癌发生的动物模型,该模型研究在NAFLD进展的各个阶段发生的基因表达信息的变化。发现在STAM小鼠中发展的HCC相当于人类BCLC分期(肝癌分期)的B或C期。从临床角度来看,模拟人类HCC发展的动物实验将促进与人类肝癌直接相关的新疗法的开发,从而为HCC的预防和治疗提供更成功的机会。
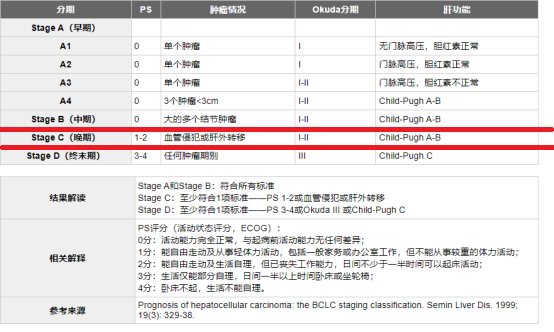
巴塞罗那分期(Barcelona Clinic Liver Cancer )肝癌分期
在疾病的每个阶段,他们对基因差异表达和基因组变异进行了更深入的分析。然后他们发现致癌信号在NASH期间被广泛激活。更重要的是,LPL/FABP4/CPT1信号轴调节的脂肪酸代谢明显上调。两者可能共同促进肿瘤起始细胞的形成,然后开始恶性转化。
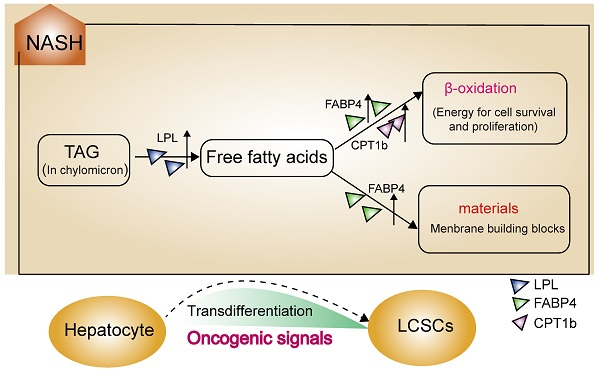
NASH阶段发生致癌信号的广泛激活
控制脂肪酸代谢的LPL/FABP4/CPT1轴具有多种生物学功能。LPL是一种限速酶,可促进富含TG的循环脂蛋白的分解,包括CM,LDL和VLDL。 一些研究提出了胶质瘤细胞依赖LPL分子作为燃料的可能性,并且胶质瘤细胞具有比正常脑组织更高水平的游离脂肪酸。FABP4是14-15 kDa家族的脂质伴随蛋白,对疏水配体(包括饱和和不饱和长链脂肪酸)具有高亲和力。FABP4已被证明在胰岛素抵抗,2型糖尿病和动脉粥样硬化中起关键作用。 此外,NAFLD患者体循环中FABP4的水平上调,与肝脏炎症和纤维化有关。最近的数据表明,FABP4在高脂肪饮食(HFD)化学诱导的HCC模型的肝组织中增加。CPT1是调节FA氧化(FAO)和维持能量稳态的主要因素。由于CPT1促进脂肪酸进入线粒体基质,线粒体基质在β氧化产生能量中起着至关重要的作用,因此CPT1已成为癌症的潜在治疗靶点。其他研究表明,CPT1b的低表达抑制了乳腺癌起始细胞的存活,而下调CPT1c的表达可有效降低乳腺癌异种移植。 综上所述,三个关键基因LPL,FABP4和CPT1,形成调节脂肪酸产生,运输和氧化的代谢轴,这对癌细胞活性至关重要。
基于这些分析,团队开展了进一步的实验室研究,从STAM小鼠模型的8周到20周,使用靶向LPL,FABP4或CPT1的小分子抑制剂进行干预,观察到腹腔注射小分子抑制剂可有效减少STAM小鼠肝脏肿瘤的数量和大小,结果表明抑制LPL/FABP4/CPT1信号轴可有效抑制体内肝肿瘤的生长。
此外,体外细胞实验也证实,靶向抑制代谢轴可显著降低肝癌干细胞的自我更新和增殖能力。
研究团队认为,抑制脂肪酸代谢信号轴可以防止NAFLD转化为肝癌,从而为NASH相关肝癌的预防提供新的思路。(转化医学网360zhyx.com)
参考资料:
https://medicalxpress.com/news/2021-11-fatty-liver-disease-cancer.html
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发