【最新研究】i•FISH单细胞测序揭密大、小CTC的不同耐药机制
| 导读 | 肿瘤细胞耐药是阻碍有效治疗肿瘤的主要原因之一,实时监测耐药及揭示相关耐药机理对提高肿瘤治疗疗效具有非常重要的作用。 |

最近,北京大学肿瘤中心消化肿瘤内科沈琳主任团队、美国夏威夷大学医学院、江苏健为医学及赛特生物密切合作,应用赛特SE-i•FISH技术针对111例晚期胃癌患者体内的大、小CTC在肿瘤耐药和预后评估等方面进行了深入研究,并通过靶向单细胞测序揭示了这些不同类别CTC的耐药机理,为进一步更好地开展肿瘤精准治疗提供了有意义的依据。相关重要成果刚刚在国际著名期刊Cancer Letters上得到发表 (Chen et al., 2021 Cancer Lett 517:78, 影响因子IF=7.360)。这是继已报道的SE-i•FISH检测出早期肺癌患者术前小细胞CTC[1] 和晚期肺癌患者化疗前小细胞CTC[2] 均与不良预后密切相关,以及i•FISH CTC单细胞测序揭示了乳腺癌肺转移过程中EpCAM+ CTC起决定作用之后[3],再次证明应用i•FISH检测各种具有不同临床意义的CTC亚类细胞及对这些亚类细胞进行单细胞测序的有效性与必要性。
文章重点
-
SE-i•FISH 检测111例入组的晚期胃癌患者CTC显示, 3倍体小细胞 (SCTCstri) 及多倍体大细胞 (LCTCsmulti) 构成了CTC的主要组成成分
-
治疗前基线小细胞CTC与胃癌肝转移密切相关
-
治疗前患者含有 ≥3个 SCTCstri 或 ≥6个 LCTCsmulti,预后较差,中位无进展生存期 (mPFS) 较短
-
治疗前患者含有≥6个 LCTCsmulti,中位总生存期 (mOS) 明显较短
-
单细胞测序及相关分析显示,LCTCsmulti 中的MET/PI3K/AKT 通路和SMARCB1 介导的染色质重塑 (chromatin remodeling),及SCTCstri 中的K-Ras、Rap1 信号传导通路,分别在大、小CTC耐药过程中发挥重要作用
人体内肿瘤细胞大小、形态各异。小细胞CTC (≤白细胞) 作为间质化肿瘤细胞的代表性特征,在肿瘤转移与不良预后过程中的重要作用近年来已受到人们日益密切的关注。本文作者对晚期胃癌患者接受紫杉醇或铂类化疗前后的不同大、小的CTC细胞进行了有效检测,通过群体数据分析锁定了与耐药及不良预后相关的CTC亚类细胞,再利用赛特“固/液双相单细胞显微分离系统”(non-laser microscopic single-cell manipulator, n-MSM) 特异性挑选具有特殊临床意义的CTC单细胞,并进行后续改良的单细胞全基因组扩增及NGS测序(健为医学)。
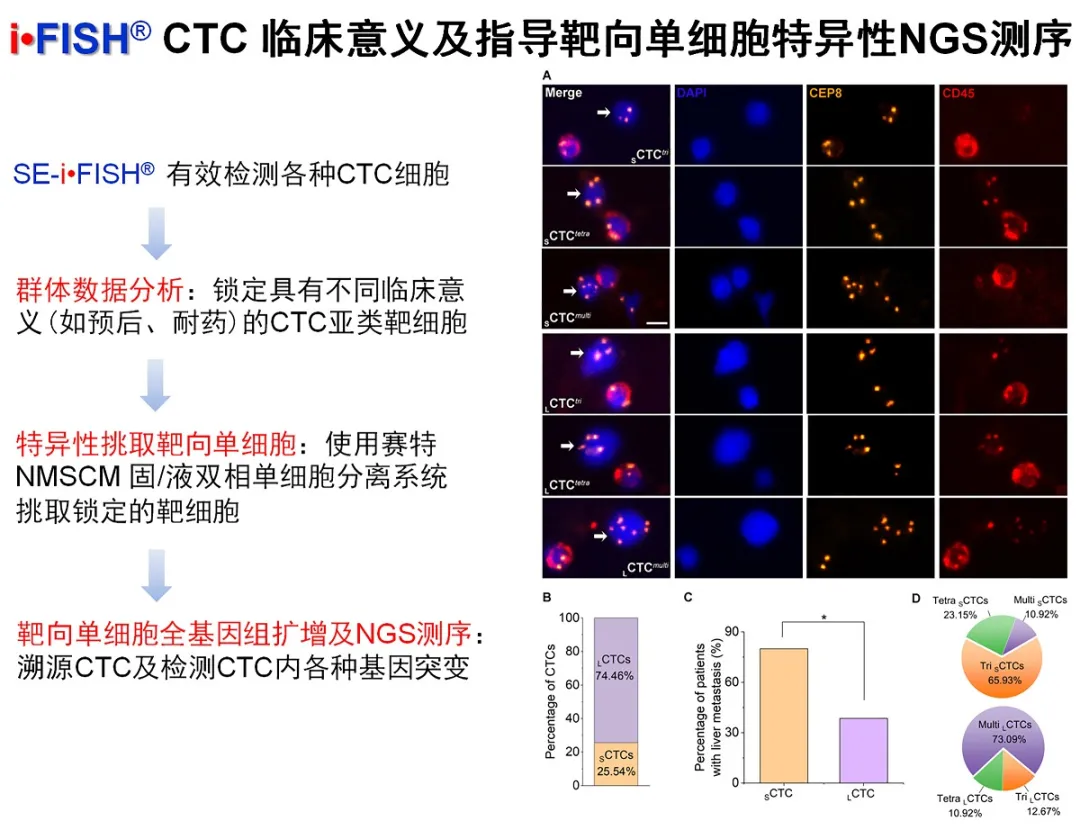
本研究检测出的胃癌CTC中,多倍体大细胞 (LCTCmulti) 及三倍体小细胞 (SCTCtri) 为主要组成部分,其中小细胞CTC与胃癌的肝转移密切相关!这与我们已报道的Vimentin+ 的间质化小细胞CTC与肺癌肝转移密切相关一致[2]。
胃癌三倍体小细胞、多倍体大细胞CTC的预后价值
三倍体小细胞 (SCTCstri) 及多倍体大细胞 (LCTCsmulti) 的多重cut-off分析显示,治疗后的患者含有 ≥3个 SCTCstri,或 ≥6个 LCTCsmulti,其mPFS 明显较短,预后较差。治疗后含有 ≥6个 LCTCsmulti的患者,预后较差,总生存率也明显降低。因此,3个SCTCstri及6个 LCTCsmulti 为胃癌预后判断的cut-off值。
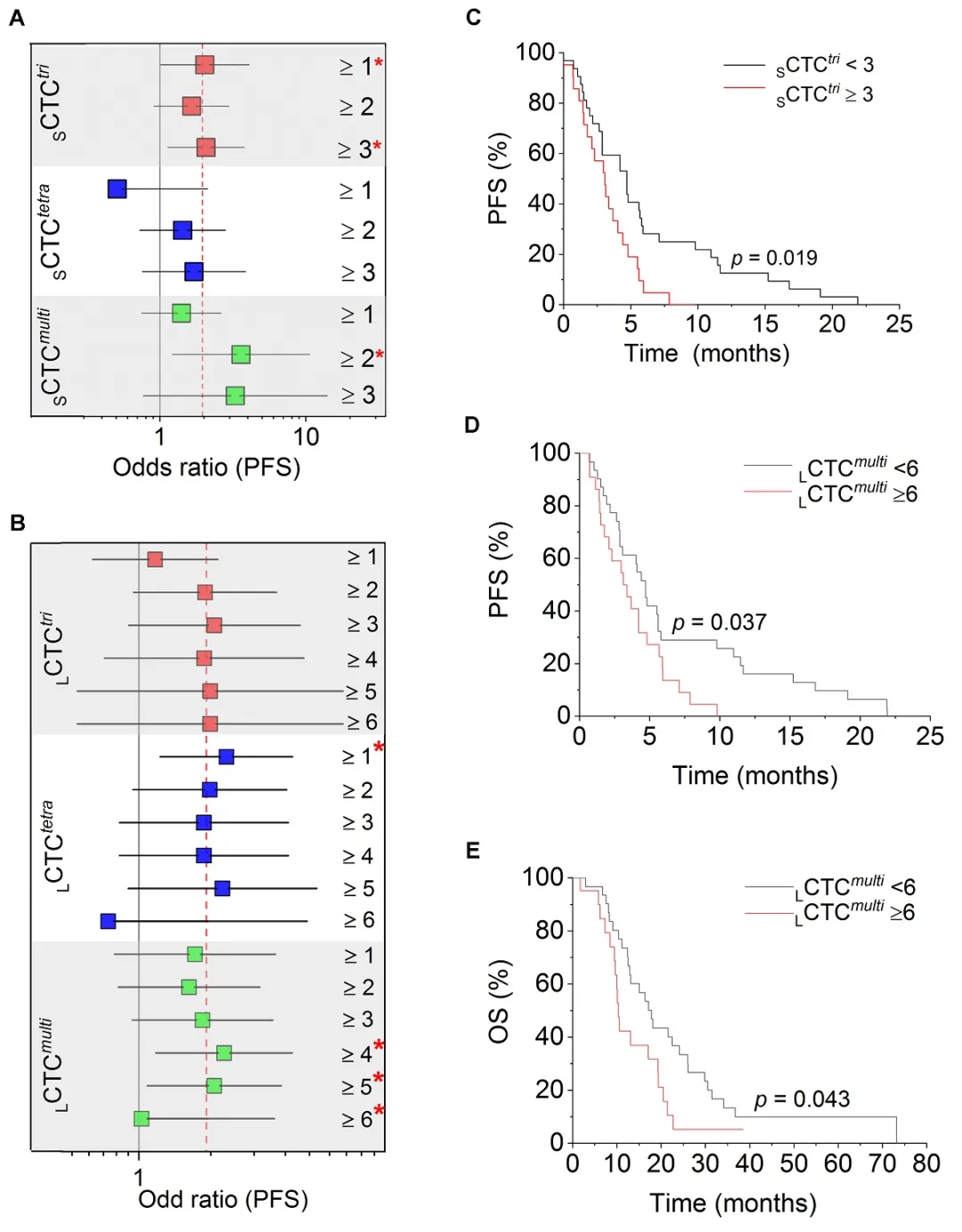
胃癌三倍体小细胞、及多倍体大细胞CTC与耐药密切相关
作者对预后较差、产生耐药的PD患者体内各种CTC亚类细胞进行了全面综合分析,群体结果显示,三倍体小细胞 (SCTCstri) 及多倍体大细胞CTC (LCTCsmulti) 显著升高。进一步的患者个体肿瘤进展热图也证实了此一发现。
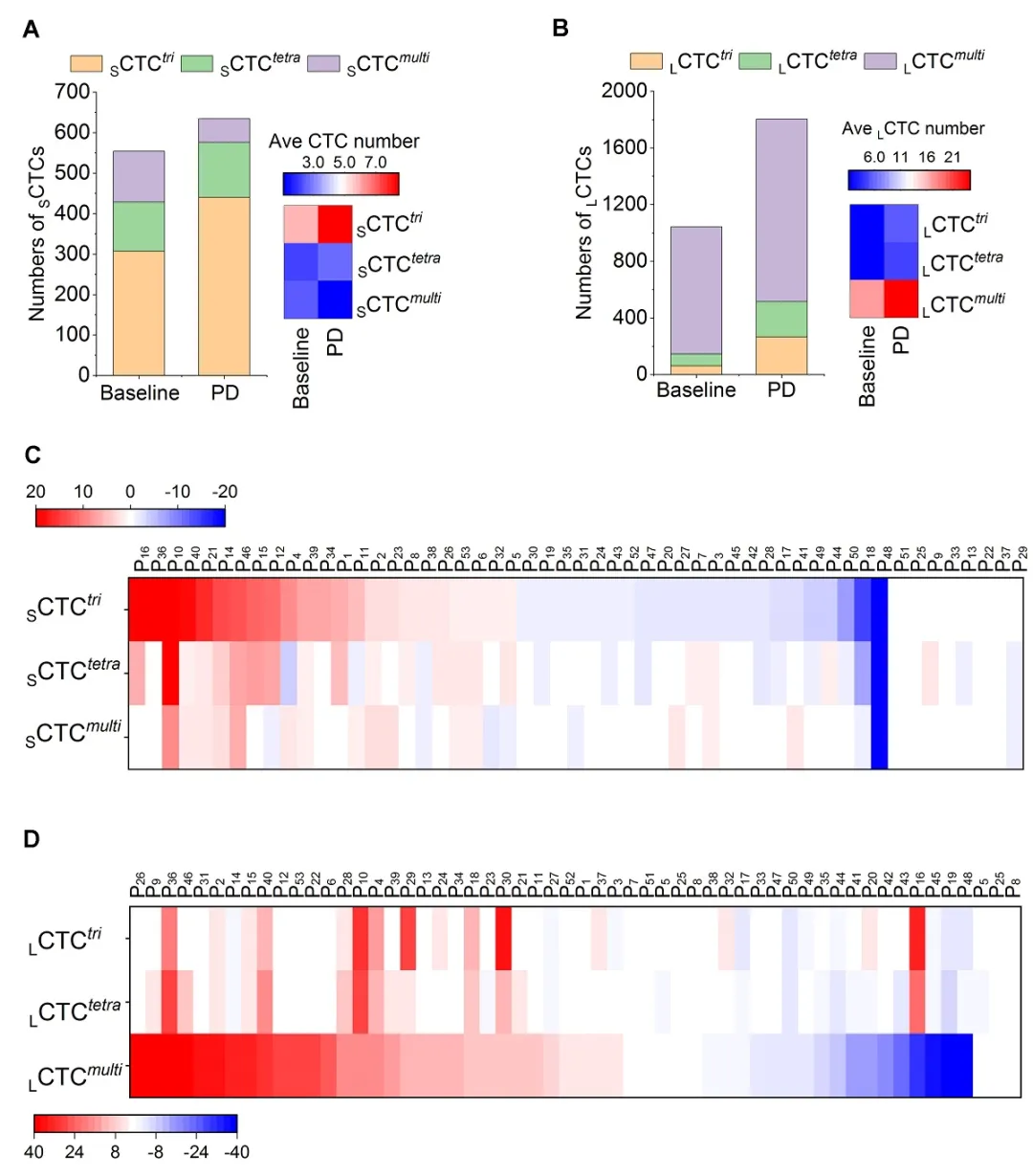
NGS单细胞测序溯源CTC
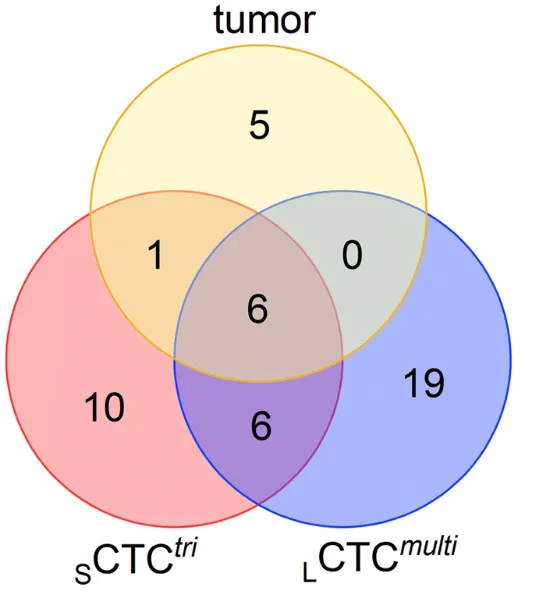
为了证明这些与耐药相关的大、小不同的CTC的确来自于原发灶肿瘤,作者在不同患者体内采集原发灶肿瘤、三倍体小细胞及多倍体大细胞CTC,进行CTC单细胞及肿瘤组织的targeted bulk 测序(健为医学)。通过Venn diagram对比这三者的基因突变发现,三者共同拥有6个相同的点突变基因,从而证明检测出的大、小CTC与原发灶肿瘤同源。CTC携带与原发灶肿瘤不同的其它基因突变是因为肿瘤细胞入血形成CTC后,经过不断演变,形成了具有各自特点的基因变异及不同形态。
NGS测序也曾成功证明,使用赛特SE方法在脑脊液中富集到的乳腺癌脑转移肿瘤细胞与原发灶乳腺癌同源,并对测序检测出具有特异突变靶点的乳腺癌细胞进行体外筛药[4]。
NGS单细胞测序揭示胃癌三倍体小细胞和多倍体大细胞CTC具有各自不同的基因突变特征
作者接下来对来自6个治疗前患者的28个小细胞 SCTCstri 及25个大细胞LCTCsmulti ,使用适于iFISH CTC的改良型MDA全基因组扩增方法,逐一进行了CTC 单细胞全基因组扩增及NGS测序(健为医学),以检测这些CTC上的所有点突变、插入或缺失突变 (Indels)。
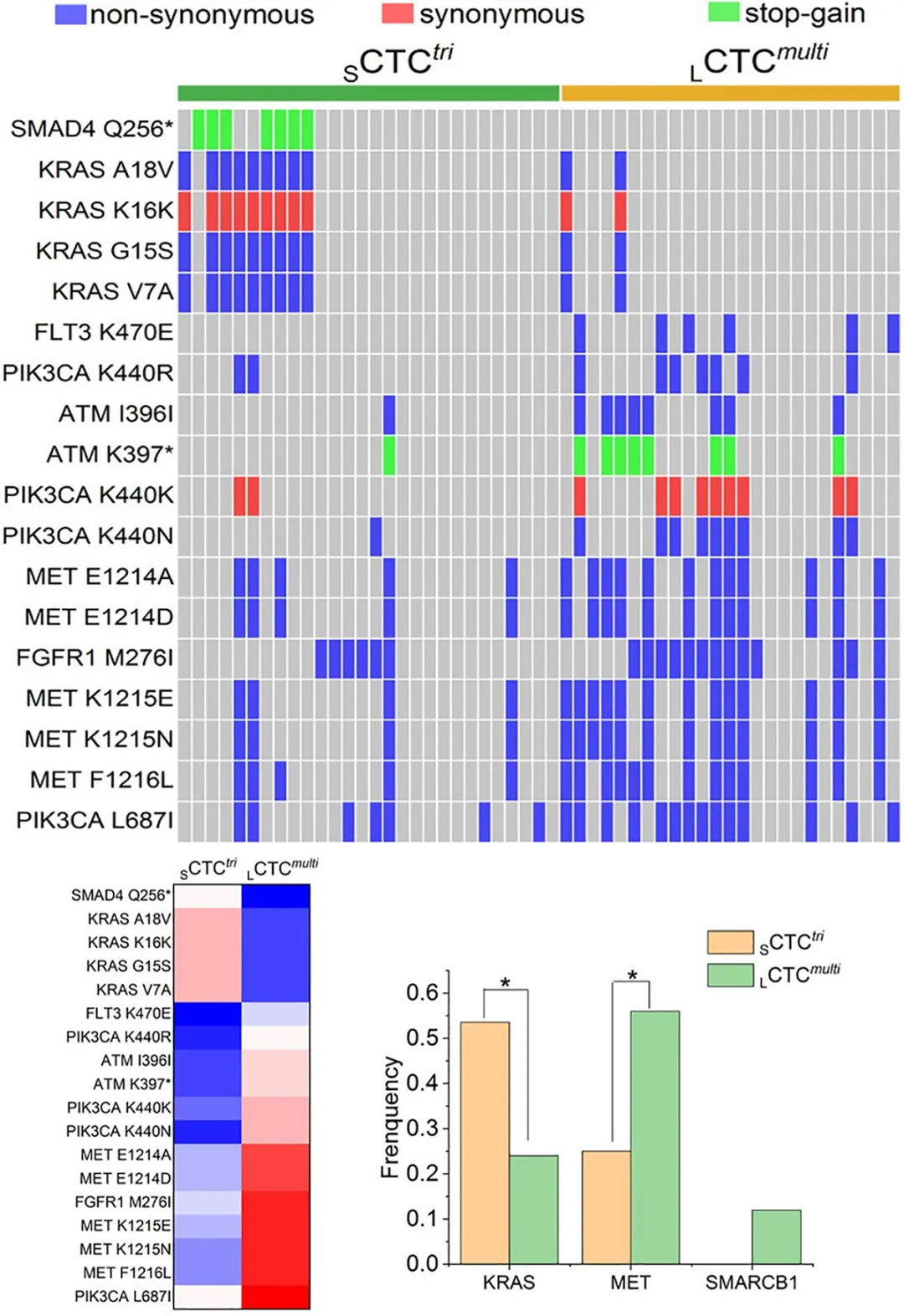
如图显示,大、小不同的两类CTC共检测出18个基因突变,包括14个非同义 (non-synonmous) 突变、 2个同义 (synonmous) 突变及2个stop-gain突变。这些突变有些是SCTCstri独有,有些是LCTCsmulti特有,也有一些是两类共有,但突变数量在两类细胞上具有显著性差异。其中,KRAS 的V7A、G15S及A18V三种突变常见于小细胞SCTCstri,MET基因的多个突变多见于大细胞LCTCsmulti。此外,在大细胞CTC中还检测到了特异的SMARCB1 突变,该基因与染色质重塑及调控产生mRNA的翻译过程密切相关。
大、小CTC细胞中与耐药相关的不同信号传导通路
KEGG分析显示,小细胞SCTCstri及大细胞LCTCsmulti内检测出的基因突变分别涉及了10余种信号传导通路 (SMP) 及细胞功能。其中,小细胞CTC内,small GTPase Rap1发生了高频突变,而Rap1 与另一个著名的 small GTPase KRAS 高度相似,两者与肿瘤细胞耐药密切相关[5]。大细胞CTC中,多种基因突变主要集中于PI3K-AKT通路。
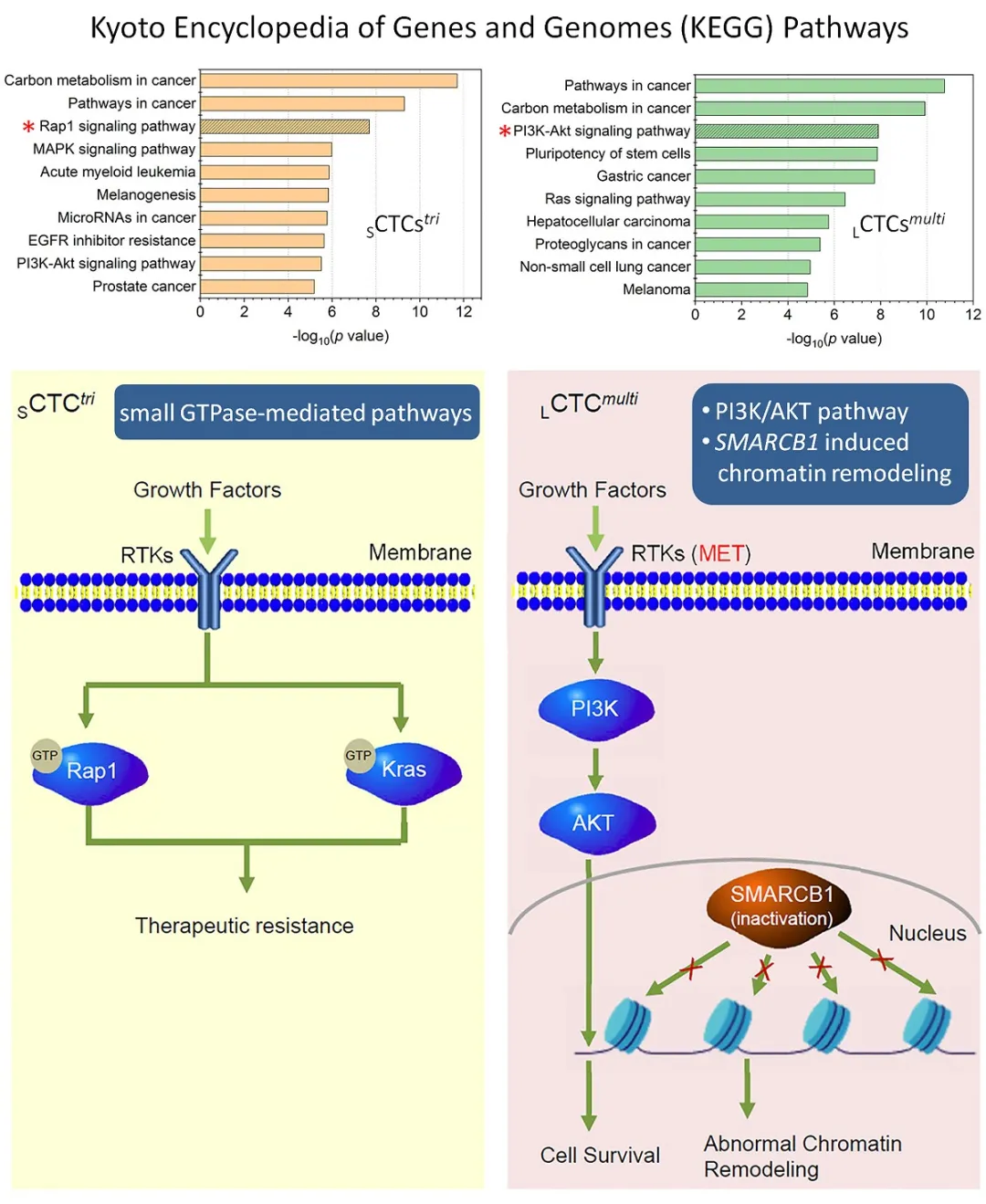
与预后密切相关的胃癌小细胞SCTCstri及大细胞LCTCsmulti具有各自不同的耐药机理。三倍体小细胞CTC内,Rap1 和K-Ras small GTPase 通过调节G-protein 、G蛋白受体 (GPCR) 形成肿瘤细胞的耐药,而多倍体大细胞CTC主要通过PI3K/AKT 通路、SMARCB1介导的染色质重塑以及对形成mRNA的“翻译”过程进行调控,从而使肿瘤细胞产生耐药。
讨论
本文对血液中的非血源性循环异倍体细胞 (circulating aneuploid cell, CD45- CAC) 进行了深入研究,并取得了一系列有意义的成果。此外,本文作者已报道了胃癌三倍体CAC具有对顺铂内源性耐药的特性[6]。最近,北京大学肿瘤中心胸外科、胸内科、北京胸科医院与赛特生物合作,联合报道了早期肺癌患者手术前和晚期肺癌患者化疗前的基线三倍体小细胞CAC 、间质型三倍体小细胞CTC (Vim+ SCTCtri) 与肿瘤侵袭、进展、肝转移、不良预后及术后复发高度相关[1, 2, 7]。
CAC主要由CD31- CTC和CD31+ CTEC (循环肿瘤血管内皮细胞) 组成,CTC可在低氧条件下通过转分化形成CTEC[8-10]。CTC及CTEC在肺癌[11, 12]、乳腺癌[13]、胰腺癌[14]等肿瘤中的不同重要作用已被不断报道。随着SE-i•FISH技术的普及,有效区分及全方位联合检测CTC与CTEC,以同步深入研究CTC、CTEC各亚类细胞的不同临床意义已成为迄今有关CTC研究的主要发展方向之一。
结论
i•FISH可在细胞三要素(染色体倍体、多重肿瘤蛋白标志物表达、细胞形态)的基础上对CTC、CTEC进行原位、综合检测。本研究证实了在i•FISH CTC上应用改良的MDA全基因组扩增开展单细胞测序的可行性与必要性(健为医学)。不同形态的CTC和CTEC,其肿瘤细胞生物学特点各不相同,分别具有非常重要的临床意义。对包括各种异质性极高的CTC、CTEC亚类细胞进行全方位检测,才能为更好地为开展肿瘤个体化精准治疗提供更加全面、客观的可靠依据。随着i•FISH CTC/CTEC单细胞测序技术的成熟与临床应用,将为人们进一步分子解析同一瘤种中不同肿瘤细胞的各种不同性状及相关临床意义、以及深入理解肿瘤细胞在不同治疗过程中 (如化疗、放疗、靶向、抑制血管生成、免疫治疗等) 如何形成耐药的各种机理提供极大帮助。(转化医学网360zhyx.com)
相关文献
1. Hong et al. (2021) Small Cell Size Circulating Aneuploid Cells as a Biomarker of Prognosis in Resectable Non-Small Cell Lung Cancer. Front Oncol 11:590952.
2. Wang et al. (2019) Vimentin expression in circulating tumor cells (CTCs) associated with liver metastases predicts poor progression-free survival in patients with advanced lung cancer. J Cancer Res Clin Oncol 145:2911.
3. Liu et al. (2019) Epithelial-type systemic breast carcinoma cells with a restricted mesenchymal transition are a major source of metastasis. Sci Adv 5:eaav4275.
4. Li et al. (2018) Clinical significance of detecting CSF-derived tumor cells in breast cancer patients with leptomeningeal metastasis. Oncotarget 9:2705.
5. Shah et al. (2019) Ras and Rap1: A tale of two GTPases. Semin Cancer Biol 54:29.
6. Li et al. (2014) Clinical significance of phenotyping and karyotyping of circulating tumor cells in patients with advanced gastric cancer. Oncotarget 5:6594.
7. Satelli et al. (2011) Vimentin in cancer and its potential as a molecular target for cancer therapy. Cell Mol Life Sci : CMLS 68:3033.
8. Lin (2018) Aneuploid CTC and CEC. Diagnostics (Basel) 8:26.
9. Lin (2020) Aneuploid Circulating Tumor-Derived Endothelial Cell (CTEC): A Novel Versatile Player in Tumor Neovascularization and Cancer Metastasis. Cells 9:1539.
10. Lin et al. (2017) Comprehensive in situ co-detection of aneuploid circulating endothelial and tumor cells. Sci Rep 7:9789.
11. Lei et al. (2020) Combined detection of aneuploid circulating tumor-derived endothelial cells and circulating tumor cells may improve diagnosis of early stage non-small-cell lung cancer. Clin Transl Med :e128.
12. Zhang et al. (2020) PD-L1(+) aneuploid circulating tumor endothelial cells (CTECs) exhibit resistance to the checkpoint blockade immunotherapy in advanced NSCLC patients. Cancer Lett 469:355.
13. Ma et al. (2020) Dynamic monitoring of CD45-/CD31+/DAPI+ circulating endothelial cells aneuploid for chromosome 8 during neoadjuvant chemotherapy in locally advanced breast cancer. Ther Adv Med Oncol 12:1-14.
14. Xing et al. (2021) CD44+ Circulating Tumor Endothelial Cells Indicate Poor Prognosis in Pancreatic Ductal Adenocarcinoma After Radical Surgery: A Pilot Study. Cancer Manag Res 13:4417.
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发