肺癌,作为发病率与致死率最高的瘤种,在全球范围内对大众健康构成了严重威胁。如何在肺癌早期诊断过程中使用无创手段有效鉴别良、恶性肺小结节具有非常迫切的临床意义。最近,中国国家癌症中心、中国医学科学院、北京协和医学院肿瘤医院赫捷院士、院长及孙楠研究员团队,应用赛特SE-i•FISH 整合技术完成的临床研究揭示,原位、联合检测的异倍体 CD31+ CTEC 及 CD31- CTC 特殊亚类细胞与早期肺癌患者的恶性肺小结节具有显著相关性,且 CTC 与 CTEC 在肺癌的不同分期阶段,其细胞大小、倍体及肿瘤标志物的表达等均有很大差异,这两类细胞功能各异,但相辅相成 (Lei et al., 2020 Clin. Transl. Med.e128. https://doi.org/10.1002/ctm2.128)。取得的重要成果对使用无创手段有效区分良、恶性肺小结节,进一步完善肺癌早诊与早筛具有很重要的临床与现实意义。此外,江苏省人民医院乳腺外科近期也报道了应用 SE-i•FISH 动态监测 EpCAM + CTEC 在局部晚期乳腺癌患者接受新辅助化疗过程中的特殊临床意义 (Ma et al., 2020 Ther Adv Med Oncol 12:1)。这是继2017年赛特生物与上海第一人民医院肿瘤中心及德国慕尼黑大学医学中心在全球首次联合发现了 CTEC 的存在 (Lin et al., 2017 Sci Rep 7:9789),及北京胸科医院与赛特生物不久前共同发表了肺癌 PD-L1+ CTEC 在免疫治疗过程中的重要意义 (Zhang et al., 2020 Cancer Lett 469:355) 以来,有关 CTEC 临床研究取得的部分最新进展。
北京协和医院肺癌中心李龙芸主任团队与赛特生物2009年首次联合报道了 SE 富集技术可成功分离肺癌 CTC (Wu et al., 2009 J Thorac Oncol 4:30)。随着临床应用改进型 SE 检测 CTC 与 CTEC 的不断深入开展,最近,著名的北京大学人民医院妇科肿瘤中心、北京大学肿瘤中心、国家癌症中心、中国医学科学院肿瘤医院相关科室及赛特生物团队,共同在《临床实验室》杂志上对血液中循环稀有细胞分类及应用 SE-i•FISH 联合检测 CTC 与 CTEC 的临床意义做了进一步详细介绍 (Cheng et al., 2020 Clin Lab 14:43)。

近年来国内外有关 CTEC 临床研究的报道不断增多。人们已意识到针对 CTEC 的检测与研究不能止步于以往简单的表象观察与单纯计数,一系列重要问题亟需完整、清晰的系统性概述,包括异倍体 CTEC 的本质是什么?它们与肿瘤细胞是什么样的关系?这些细胞从何处来,又到何处去?以及 CTEC 的临床与生物学意义又是什么等。最近在《Cells》(Basel, Switzerland) 专刊上发表的相关文章对上述 CTEC 的这些重要问题进行了深入探讨 (Lin, 2020 Cells 9:1539) 。

文章作者为赛特生物林平博士。本专刊特邀编辑 Dr. Olivier Gires 教授, 任职于著名的德国慕尼黑 Ludwig-Maximilians 大学医学中心,是国际知名的 CTC 、EpCAM、EGFR 等领域的专家,在 Nature Cell Biology, Science Advances, Cancer Research 等一流杂志上发表过多篇论著。
肿瘤脉管系统
肿瘤脉管系统主要由血管及淋巴管构成,它们与肿瘤的发生、进展、转移密切相关。肿瘤新脉管生成主要经历“血管形成 (angiogenesis)”、“血管发生 (vasculogenesis)” 及“淋巴管形成 (lymphangiogenesis) ”,内皮细胞构成了脉管系统的内膜。此外,肿瘤干细胞可直接形成无内膜结构的、连接肿瘤细胞与血管的特殊管道系统(即血管生成拟态 VM channel),其与肿瘤转移相关。
肿瘤内皮细胞 (TEC) 与 CTEC 的来源
肿瘤脉管系统的内膜主要由异倍体“肿瘤内皮细胞 (Tumor-derived Endothelial Cell, TEC)” 构成,它们可由肿瘤细胞直接转化而来。TEC, 顾名思义,其本质是一类表达了内皮标志物 CD31 的特殊肿瘤细胞,这些细胞脱落入血后形成了循环肿瘤内皮细胞CTEC。TEC可通过“内皮细胞肿瘤化” (cancerization) 及“肿瘤细胞内皮化” (endothelialization) 这两种途径产生,其中,肿瘤细胞内皮化可分为 “转分化”和起主要作用的“细胞融合”两种形式。
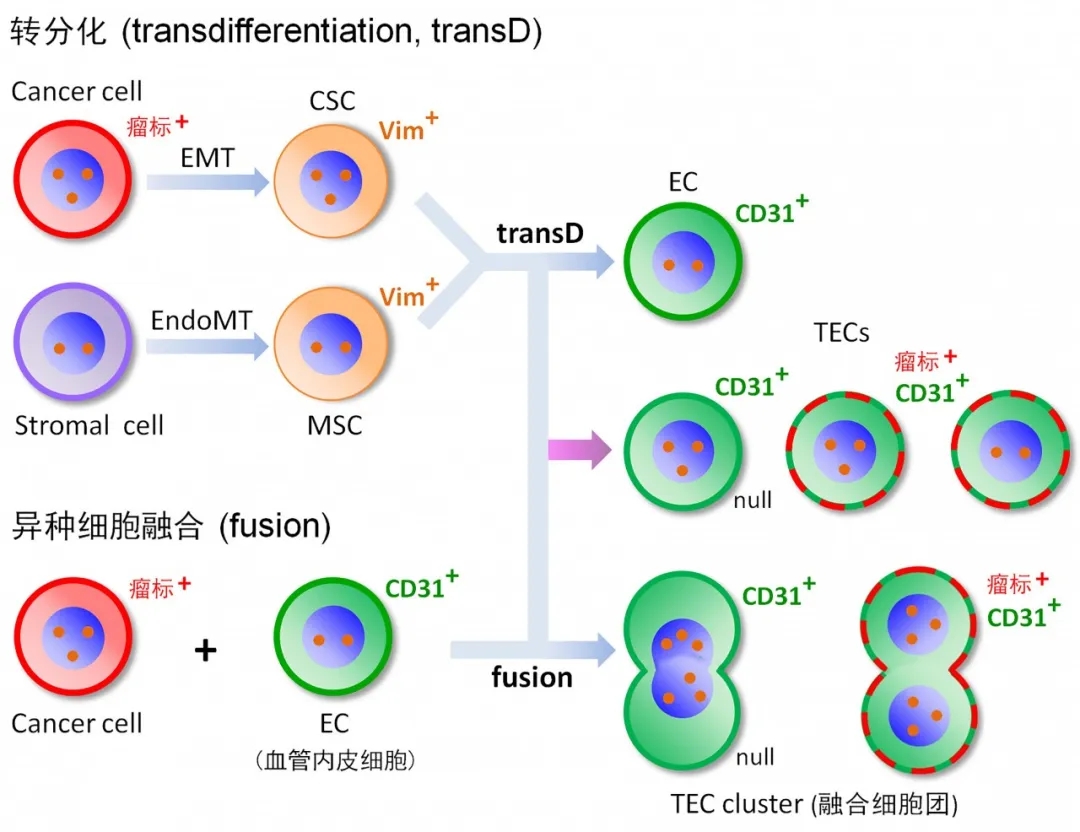
转分化 (transD):肿瘤细胞通过 EMT 过程中的“去分化”形成具有干细胞特征的肿瘤干细胞 (CSC)。CSC 再通过“转分化”可在体内或体外低氧条件下形成异倍体 TEC,其入血后形成 CTEC 。基质细胞 (stromal cell,包括肿瘤相关纤维母细胞 CAF、周皮细胞、血管内皮细胞等) 可经过“内皮细胞向间质细胞转化 (EndoMT)” 过程形成间质型干细胞/基质细胞 (MSC),并进一步通过“转分化 (transdifferentiation)”形成 TEC。肿瘤患者体内通过“转分化 transD ”形成的 TEC 及 CTEC 中,有些可表达肿瘤标志物,而那些不表达肿瘤标志物的 CTEC 则被称为裸细胞 (null CTEC)。
正常人体中有时出现的单个异倍体 CD31+ 裸细胞被称为“异常循环内皮细胞” (abnormal CEC),它们来源于基质细胞的转分化 (EndoMT通路) 或细胞老化。这类细胞与肿瘤无关,也不具有任何临床意义,最终会被维持体内平衡 (homeostasis) 的免疫系统清除掉。
异种细胞融合 (fusion):肿瘤细胞内皮化的另一主要途径是“细胞融合”。异种细胞融合指的是两个不同种类细胞的融合,可产生单核或多核融合细胞,融合细胞在肿瘤的发生与进展过程中起着非常重要的作用。很多肿瘤细胞均具有融合性,融合后产生的细胞与原有肿瘤细胞相比,因有丝分裂的改变而使细胞恶性度、转移能力等均明显提高。此外,细胞融合也是肿瘤细胞产生染色体异倍体特征的主要原因之一。炎症与肿瘤密切相关早已被报道 (Balkwill et al., 2001 Lancet 357:539),在 TNF-α 诱导的炎性环境中,肿瘤细胞可与正常的内皮细胞发生融合,形成单个异倍体 TEC 或 TEC 细胞团。与上述“转分化”相比, 肿瘤细胞与EC的融合在 TEC 产生过程中起着更为主要的作用。
低氧 (hypoxia) 诱导 TEC 与 CTEC 的产生
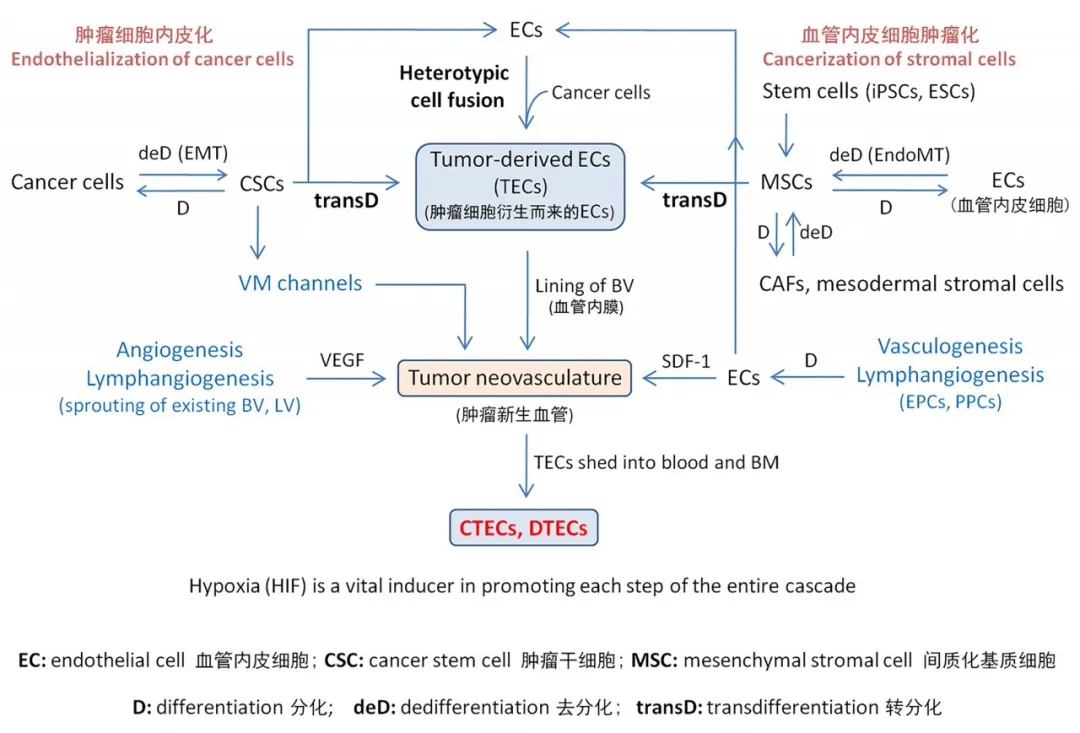
低氧是肿瘤微环境中最常见的现象。如图所示,在肿瘤血管生成的过程中,以“转分化”和异种细胞融合为基础的“肿瘤细胞内皮化”与“内皮细胞肿瘤化”共同形成了 TEC。肿瘤微环境中常见的低氧是图中所有步骤的诱导因素,EMT 及 EndoMT 是整个流程的中心, CSC 和 MSC 为重要节点,细胞融合与去分化 (dedifferentiation) 是关键步骤,最终形成核心产物 TEC 与 CTEC。低氧的肿瘤微环境可激活肿瘤血管生成过程中的HIF通路、诱导 EMT/EndoMT、transD 及细胞融合,从而促进肿瘤的发生、进展、转移、新血管生成等。在此过程中,一系列涉及 NFkB、Twist1、Notch、Wnt/β-catenin、MAPK、mTOR、Snail、TGF-α/β、VCAM-1、PECAM-1等因子的细胞内信号传导通路被激活,不断产生新的 TECs 及 CTECs。此外,体内低氧环境也能在体外模拟实现,如1% O2 或 CoCl2 可在体外诱导多种培养的 CD31- 肿瘤细胞系细胞直接转化成 CD31+ 肿瘤内皮细胞 TEC,并在体外3D 培养体系中形成管状结构。
CTEC 及 DTEC 的特殊临床意义
异倍体 TEC 兼具了肿瘤细胞及内皮细胞的双重特性。除外周血中的 CTEC 外,骨髓、胸腹水、脑脊液等中的 TEC 被定义为播散性 TEC (disseminated TEC, DTEC)。CTEC、DTEC 在 TEC 的基础上获得了可移动特性。这些可移动、最终进入体液的 CTEC 和 DTEC 与肿瘤淋巴转移、血路远端定向靶器官转移、肿瘤进展、转移灶肿瘤微环境新血管及新淋巴管的生成等密切相关。
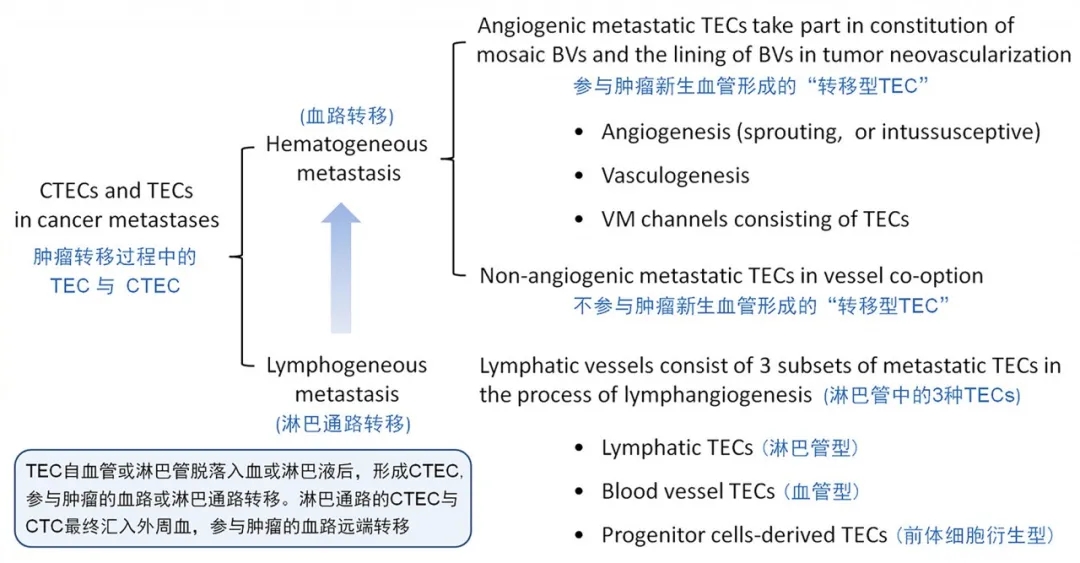
与 CTC 相比,CTEC 在具有恶性肿瘤细胞特性的基础上,还有额外新生肿瘤血管的功能。此外,临床研究显示,对于接受免疫治疗的肺癌患者,耐药的 PD-L1+ CTEC相比 CTC 而言,具有与肿瘤进展更为密切的相关性 (Zhang et al., 2020 Cancer Lett 469:355)。
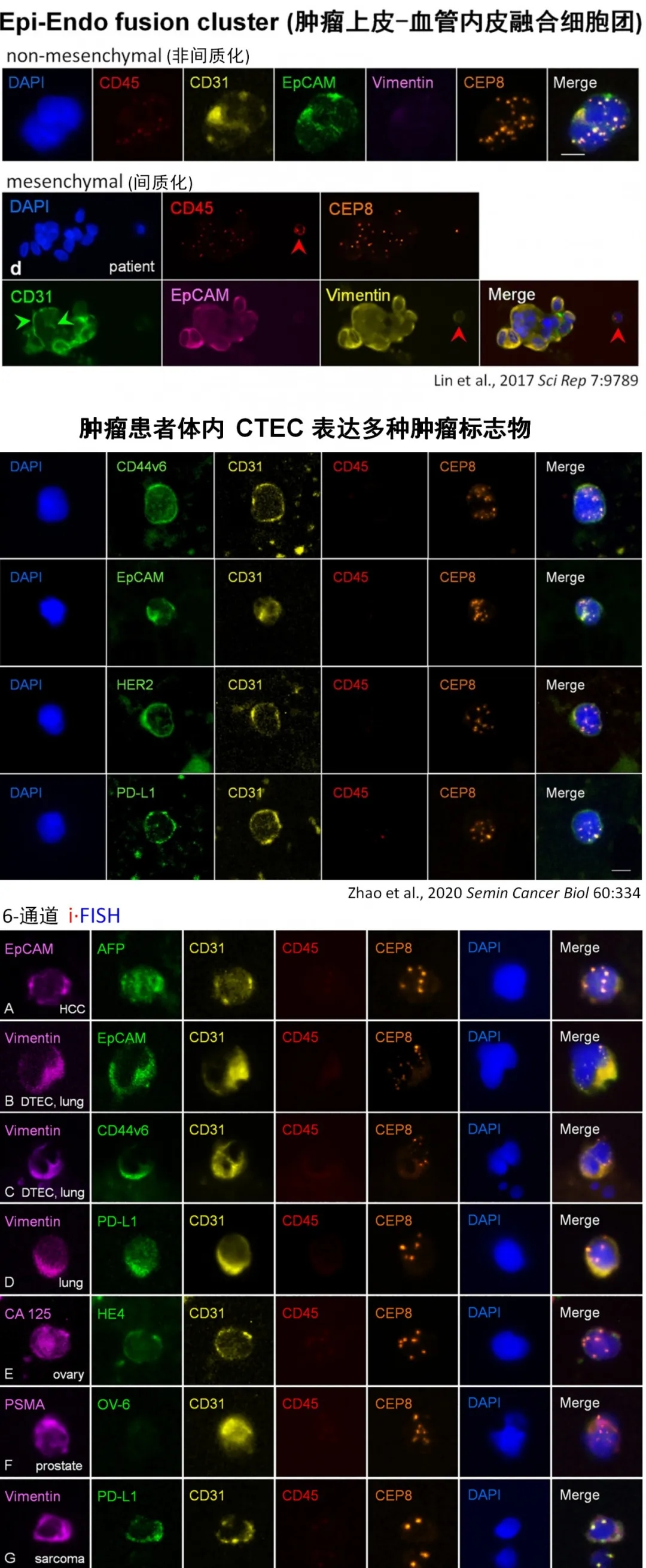
迄今为止,改进型 SE-i?FISH?可在各种不同瘤种的实体肿瘤患者体内有效同步检测出 CTC 以及表达了多种肿瘤标志物的 CTEC、DTEC (Zhao et al., 2020 Semin Oncol 60:334),它们既可以是间质型 (Vimentin+ ),也可以是非间质性。有关这些表达了不同肿瘤标志物的 CTEC、DTEC 的临床意义的研究,目前正在积极开展过程中。
结论
※ 肿瘤患者体内的异倍体肿瘤血管内皮细胞 TEC 的本质是披着 CD31 外衣的肿瘤细胞,它们被形象地比喻为“披着羊皮的狼” (Duelli et al., 2003 Cancer Cell 3:445)。TEC 主要由“内皮细胞肿瘤化”和“肿瘤细胞内皮化”产生,过程中涉及了 EMT 和 EndoMT。TEC、CTEC 及DTEC 兼具了恶性肿瘤细胞及参与肿瘤新脉管生成的内皮细胞双重特性,是内皮化的特殊肿瘤细胞。
※ CD31+ CTEC 与 CD31- CTC 是两类不同的细胞,具有不同的临床意义,检测过程中两者绝对不能混为一谈。建立在有效识别、区分这两类细胞基础上的特异性检测技术是肿瘤精准液体活检的重要前提与基础※ 正常人血液中偶尔出现的 CD31+ 异倍体循环内皮细胞 (单个异常 CEC),主要来自于基质细胞转分化或细胞老化,与肿瘤无关,可被机体免疫系统清除※ 不同于小片段 ctDNA,CD31- CTC与CD31+ CTEC 共同构成了一对具有生物活性、集蛋白与完整核酸信息于一身,且眼见为实的“细胞型循环肿瘤标志物”。它们存在于外周血、骨髓、胸腹水、脑脊液等各种不同体液中,且具有不同的临床意义。CTC 与 CTEC 相互协调,在肿瘤的发生、进展、转移、耐药、复发等过程中发挥着关键作用

英文原文链接:http://www.cytointelligen.com/zlwz关于赛特生物
赛特生物成立十多年以来,一直潜心专注于 CTC 及 CTEC 检测新技术的开发、临床应用与科学研究,是一家集研发、生产、销售、服务于一体的创新型高新科技企业。赛特生物在全球首创出拥有自主知识产权、能够有效同步分离、鉴别和分型 CTC、CTEC 的“多重瘤标免疫荧光染色-染色体荧光原位杂交” ( SE-i?FISH? ) 整合技术。SE-i?FISH? 系列产品以其高灵敏、高特异、全方位分析的特殊技术优势,已被国内外众多用户广泛采用。赛特生物积极参与、协调国内外广大肿瘤界同行的多项密切合作,竭力打造肿瘤液体活检领域内的领先技术产品,并始终如一地致力于推动肿瘤精准诊断与治疗的进步和发展

阅读原文








 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发