
2006年,日本科学家山中伸弥(Shinya Yamanaka)教授利用逆转录病毒将4个转录因子转入成体细胞,将其转变为诱导多能干细胞(induced pluripotent stem cells, iPSC)。从此后,诱导多潜能干细胞研究领域取得了极大进步,被用于研究人类疾病,目前已经有多项研究进入到临床实验阶段。CRISPR/Cas9基因编辑系统已成为目前最常使用的基因编辑工具,在基因组中生成靶向DNA双链断裂(Double strand breaks, DSBs),再通过内源性细胞DNA DSB修复途径进行修复。将CRISPR技术与iPSC技术结合,将模拟疾病发生的突变引入iPSC,或修复iPSC疾病模型中的突变, 再分化得到所需要的特定细胞进行研究或疾病治疗,是目前iPSC研究和转化领域的热点。
目前,基于CRISPR/Cas9技术在靶向区域形成DNA双链断裂(DSB),利用非同源末端连接(Non-Homologous End Joining , NHEJ)方法导致插入和缺失突变,而微同源性末端连接(Microhomology-Mediated end Joining, MMEJ)则导致可预测缺失。NHEJ和MMEJ统称为诱变末端连接(Mutagenic End Joining,MutEJ),两种修复结果均可导致DNA序列的丢失或增加。与定制修复模板如供体质粒或单链供体寡核苷酸(Single-stranded donor oligonucleotide,ssODN)结合,利用同源定向修复(Homology-directed repair, HDR)途径可实现单核苷酸改变。然而基因精确敲入效率低下和适用性有限,需要采用定制ssODN模板进行优化HDR编辑效率。
HDR方式是复杂而精确的,需要同源序列模板,只能发生在细胞G2/S期。NHEJ方式是快速非精确的,过程中可能会随机的引入和去除几个碱基,整个细胞周期都有活跃发生的。有多种策略来提高HDR率,如单独控制DNA修复,细胞周期进程或核酸酶试剂和同源修复模板可用性,但迄今尚无明确证据表明这些策略的协同效应。
日本京都大学iPS细胞研究所的科学家最新研究表明(Nature Communications,2020),DNA DSB修复与细胞周期之间有协同作用,有利于ssOND介导的单核苷酸基因编辑。在iPS细胞中建立了基于GFP到BFP转化的荧光DNA修复测定方法,可视化定量单等位基因和双等位基因靶向过程中DNA修复结果的频率。研究发现,通过特定培养条件和小分子调节DNA修复和细胞周期,可协同增强同源性定向修复(HDR)的频率。但是,高频HDR编辑主要导致双等位基因报告基因系统中纯合突变体的产生,为了在这些条件下生产杂合突变体,这个团队采用了使用混合ssODN修复模板的策略,来保护具有沉默突变的一个等位基因。在内源性常染色体位点应用此协同基因编辑策略,与基线HDR水平相比,精确编辑生成的杂合和纯合突变提高了几倍。
考虑到基因编辑的iPS细胞在细胞治疗中应用,采用符合GMP标准的Maxcyte电转仪测试设定的实验条件,比较正常培养,冷休克,冷休克和N+S条件下DNA修复结果频率,在两种不同供体遗传背景下产生杂合和纯合GFP iPS细胞系。利用Maxcyte电转技术,在冷休克条件下,结合XL413和N+S处理,在杂合GFP iPS细胞的单等位基因编辑过程中,同源性定向修复(HDR)结果达到83.3%,在纯合GFP iPS细胞的双等位基因编辑中,HDR结果达到了96.6%。此外,当采用混合ssODN M和B修复模板编辑纯合GFP iPS细胞时,获得了32.2%的复合杂合子。实验人员由此得出,协同基因编辑导致所有目标基因座上HDR频率提高了几倍,证实了该策略在靶向人类基因组方面的广泛适用性。
5个基因座(KCNH2 N588D/N588K, APRT M136T, HES7 R25W and PSMB8 G201V)上,在XL+N+S处理下32个克隆中获得18-23个具有HDR等位基因(56%-72% 总HDR效率)。与N+S联用时,XL413引起的细胞周期停滞对HDR率的影响强于冷休克处理。其他5个基因座(KCNE1?D85N,?KCNH2?N45D,?SCN5A?A1428S, and?KCNJ11?T293N/T294M)的编辑效率低由于gRNA活性低。
总之,这些结果证实了,在不同电转仪器和iPS细胞系间,通过细胞周期同步和DNA修复途径调节的协同基因编辑可有效地产生纯合和复合杂合突变克隆。参考图1
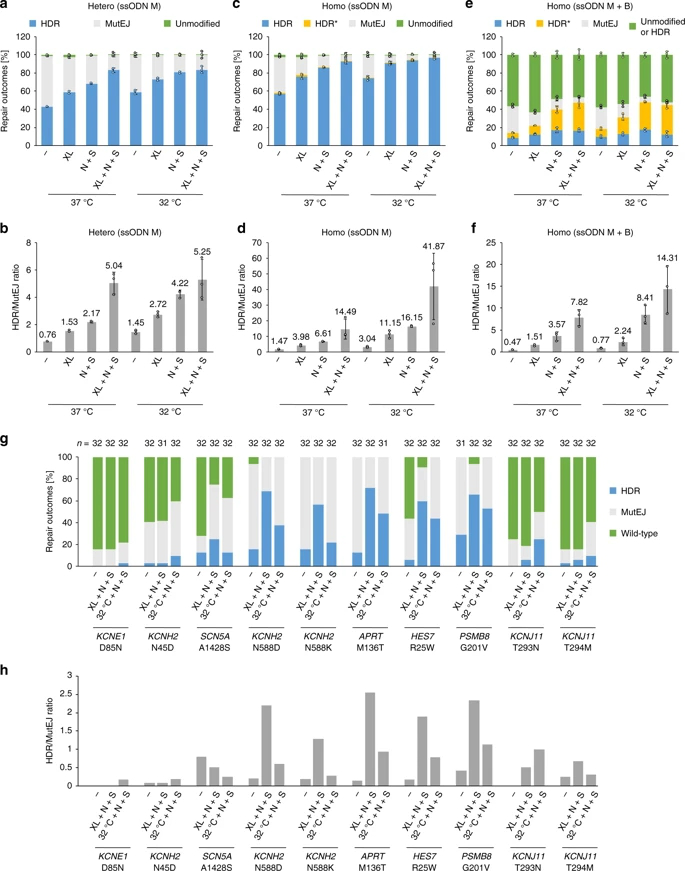
图1
研究结论及意义
研究人员采用化学和细胞培养条件干预措施,在人iPS细胞ssODN介导的基因编辑过程中,试图使DNA修复结果偏向于HDR。冷休克已被证明在低温下对细胞功能有多种影响,例如细胞代谢减慢,凋亡途径激活,基因表达改变和细胞周期停滞。基因编辑实验中,冷休克可提高HDR效率,但其机制仍不清楚。本研究表明冷休克可减慢细胞周期进程,使细胞处于G2/M期累积,并降低DNA合成速率。另外,冷休克可通过其他细胞周期依赖的效应来表现,如核酸酶稳定性、gRNA结合或DNA裂解动力学和修复中间体的稳定性,翻译后调控和细胞活力。参考图2
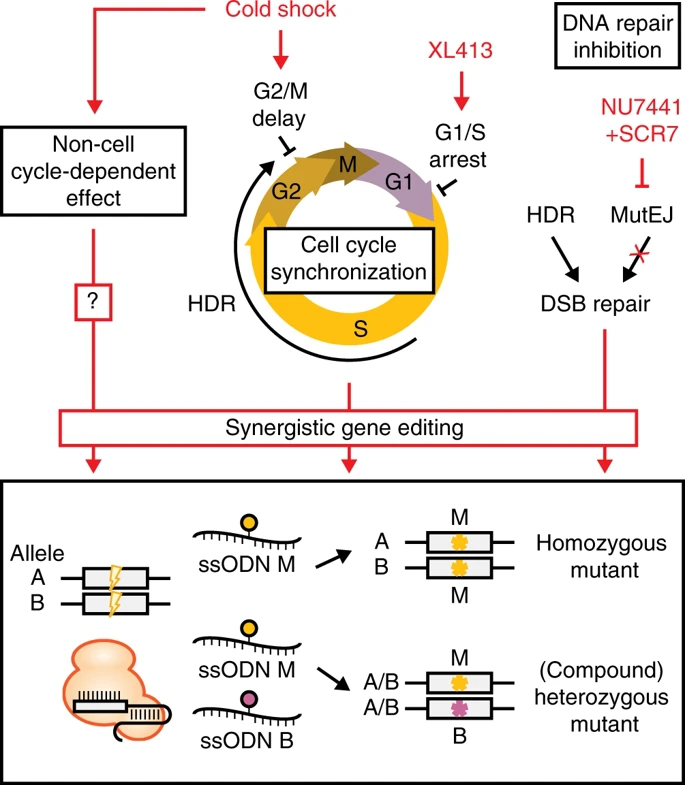
图2
细胞周期调节是DNA修复和基因编辑领域中持续不断的研究课题。本研究报道了在iPS细胞中CDC7抑制剂XL413可增强基因编辑。XL413在癌细胞系中在S/G2/M期积聚细胞,在核型正常细胞中阻滞在G1/早S期,与iPS细胞中观察一致的。
研究人员发现,NHEJ抑制剂NU7441和SCR7分别提高了iPS细胞中HDR效率,联合使用时,进一步提高了HDR效率。DNA-PKcs在DSB形成后被特异性激活,并募集NHEJ途径的蛋白组分,包括可连接DNA末端的DNA连接酶IV。作者怀疑利用NU7441抑制DNA-PKcs可能会绕过NHEJ复杂的装配,并允许选择其他替代DNA修复途径,而对于下游利用SCR7抑制DNA连接酶IV,细胞可能已经致力于利用NHEJ或其他替代MutEJ修复。这可能解释,与SCR7处理相比,NU7441具有更高的HDR效率。研究人员第一次报告细胞周期同步和DNA修复途径调节对精确基因编辑有协同影响。
使用本研究的方法,在不同电转平台间,协同基因编辑作用结果相似的。在纯合GFP iPS细胞的双等位基因编辑中,与NEPA Gene电转仪HDR 48.9%比,Maxcyte具有更高的效率,HDR结果达到了96.6%, 编辑效率高了2倍。与以前报道一致,通过精确地单等位基因编辑形成的单个HDR等位基因主要与第二等位基因中插入缺失配对。因此,采用混合ssODN策略来创建可防止Cas9再裂解的复合杂合突变等位基因,当采用混合ssODN M和B修复模板编辑纯合GFP iPS细胞时,Maxcyte获得的复合杂合子比NEPA Gene高了2.9倍(32.2% vs 11.2%)。考虑到基因模型的内源性靶标,在多个基因座上实验产生纯合和复合杂合突变,结果证明协同基因编辑始终将HDR结果频率提高到基线HDR水平的几倍。
总之,研究人员建立了一个双等位基因报告系统,该系统能够解决特定的等位基因DNA修复结果,并定义了协同基因编辑条件,可使用冷休克,细胞周期同步和DNA修复调节来提高HDR和HDR/MutEJ比率。利用高效的双等位基因修饰方式,展示了产生复合杂合iPS细胞系的策略。根据研究结果可预测,提高双等位基因编辑结果的可靠性将极大地促进显性和隐性遗传疾病模型的产生,结合符合GMP标准的转染技术,甚至可能促进使用人iPSC细胞疗法的临床开发。
参考文献:
Thomas L. Maurissen & Knut Woltjen. Synergistic gene editing in human iPS cells via cell cycle and DNA repair modulation. Nature Communications. 08 June 2020https://www.nature.com/articles/s41467-020-16643-5#Abs1
Author:Department of Life Science Frontiers, Center for iPS Cell Research and Application (CiRA), Kyoto University, Kyoto, 606-8507, Japan
关于Maxcyte公司
Maxcyte是一家临床阶段细胞免疫治疗和生命科学公司,是细胞疗法领域早期的先驱公司之一,总部位于美国马里兰州盖瑟斯堡。作为一家全球运营的生物科技公司,利用专利性的非病毒细胞工程平台,即流式电转技术平台,为全球生物医药行业的合作伙伴赋能,帮助客户开发创新性的细胞疗法,来满足病人对先进细胞疗法的需求。利用Maxcyte ExPERT电转平台结合基因编辑手段安全高效可高度重复地对人体原代细胞进行遗传改造,在符合临床使用的严格标准前提下,用于治疗遗传性疾病和癌症。Maxcyte具有全球技术支持网络,目标是帮助合作伙伴释放它们产品的所有潜能。
Maxcyte已被全球范围内用户认可,全球前十制药公司都采用Maxcyte技术平台进行药物研发,欧美主要基因编辑和细胞治疗公司与Maxcyte合作进行新型的基因和细胞治疗产品开发,如Allogene therapeutics,Editas medicine,CRISPR Therapeutics,Precision biosciences和Kite pharma等。多个顶级学术研究机构采用Maxcyte技术研究哺乳动物细胞和干细胞, 如日本京都大学iPS细胞研究所(CIRA)和美国宾夕法尼亚大学。
更多产品及技术信息,请联系Maxcyte中国总代理冷泉港生物科技股份有限公司
郝殿明
电邮:brownhao@cs-biotech.com
微信:brownhao
手机:+86-13621968804



 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发