【专访】成都美杰赛尔科学家分享,全球首例CRISPR编辑T细胞制品的临床研发
| 导读 | 《自然•医学》在线发表世界首个基因编辑I期临床试验结果。我们深度访谈了文章的共同一作:成都美杰赛尔生物科技有限公司首席科学家邓涛博士及项目总监喻堃博士。 |
衷心感谢:华西医院李为民院长等院领导对项目远见卓识的认知及大力支持、临床肿瘤学专家卢铀教授及其团队的精心统筹、魏于全院士及国家重点生物治疗实验室对项目的支撑、华西医院国家药物临床试验机构GCP病房主任梁茂植和王永生教授以及国家成都新药安全性评价中心(成都华西海圻医药科技有限公司)鼎力协助。合作各方的精诚协作、省市区各级领导及政府的关心、川发展产业振兴基金等投资方的支持。
2016年7月和11月,《Nature》曾两度头版头条报导中国开展全球首例CRISPR编辑T细胞制品治疗肺癌的临床试验。由于该实验先于美国免疫细胞治疗同类产品开始临床,引起国际媒体广泛关注和热评。自然杂志副标题甚至认为该事件触发了中美生物医学竞备大赛,使用了Sputnik这个单词——该单词是当年美苏太空竞备战时的专有名词。
今年2月,《SCIENCE》杂志报导了美国首个Crispr编辑T细胞疗法的部分临床结果,共治疗了3例患者,均显示了良好的安全性和一定的有效性。
4月28日,四川大学华西医院卢铀教授团队在《Nature Medicine》期刊发表的最新研究成果显示,使用CRISPR-Cas9编辑的T细胞在临床上治疗肺癌是安全可行的。产品开发方成都美杰赛尔和临床完成单位华西医院为并列第一作者。
转化医学网对全球首例CRISPR编辑T细胞临床试验PD-1基因编辑细胞制品的研发生产企业成都美杰赛尔生物科技有限公司首席科学家邓涛博士及项目总监喻堃博士进行了深度访谈。
以下为访谈内容:
转化医学网:邓博士您好,该临床实验的背景是什么?您的团队怎么想到要开发这个产品的呢?
邓博:PD-1单抗药品在2014年末显示出了广谱有效性,但当时价格达到90万-120万人民币每人每年。结合肿瘤免疫治疗和细胞治疗时代开启的发展趋势,希望集成前沿生物技术,开发出创新的细胞生物治疗技术和产品,满足肿瘤患者的急迫需求。思考能否用最前沿的基因编辑技术把T细胞上的PD-1基因删除,这样或许能够和PD-1单抗起到异曲同工的效应,还可能有更持久的疗效,因为理论上机体能够形成记忆T细胞,而且可以大大降低治疗成本。为了尽快推动项目,通过“集成”各方资源、协作公关,在较短时间内创建了生产制备临床GMP级PD-1基因编辑T细胞制品条件。并与四川大学华西医院胸部肿瘤科卢铀教授达成合作意向,首先在华西医院通过了新技术伦理委员会答辩,并于 2016年1月完成在Clinical Trail上的正式注册。半年后,2016年6月美国生物治疗领域领军人物Carl June团队在NIH进行新技术答辩,其项目在基因编辑敲除PD-1思路上与我们完全一致,当然在此基础上他们还添加了一个针对骨肉瘤的TCR靶点。反映我们的科学思路、基因编辑PD-1靶点选择预见的正确性。无可否认,也正是美国团队通过NIH新技术答辩,进一步促进、加速了此前我们已经初步计划开始的临床试验,尤其是在伦理审批等方面。正如《自然》杂志评述认为,这种中美在生物技术的竞赛有利于人类科技进步。我个人深刻感受到,就本次事件,的确互相促进了基因编辑技术的转化临床研究,结果互为印证,实际上是一种间接的“全球化科技合作的结晶”。
在《Nature》新闻报道后,我们的临床试验从此前计划按华西医院新技术I期临床转化试验,升级为参照新药级I期临床试验标准实施,所以我们的细胞制剂实际可能当时在中国细胞治疗界比较早按照新药标准进行临床I期进行试验的,所有实验均参照GCP法规标准完成。
关于临床批件相关问题说明:
1. 该项目我们在与华西医院签署协议及在美国clinical trial注册时均是以成都美杰赛尔作为制品/技术提供方和申报方,华西医院作为临床GCP承担方;
2. 项目启动时在华西医院分别通过了新技术专家认证会、新药GCP伦理委员会。在该项目被《自然》杂志头版头条报导并引起全球广泛关注后,华西医院党政联席再次举行了30多位各方面专家参加的GCP大伦理委员会专家认证,并决定在临床保障等各方面给予项目大力支持;
3. 由于项目申报时CFDA尚无关于细胞制品管理的明确管理规定出台(即药品/技术两条路径不明确),但基于项目的重要性和紧迫性,因此当时以华西医院临床方按新技术报备了卫计委,但项目实施过程完全按照新药GCP规范流程执行,并请CRO公司全程监督;
昨天为期两年多的I期临床实验结果正式在《自然医学》发表。
在启动首例PD-1基因编辑T细胞治疗肿瘤I期临床转化试验时,没有任何先例可循。作为I期临床试验主要观察产品的安全性和可行性,尤其是基因编辑脱靶等潜在风险,现在我们可以负责任的说:安全、可行、初步的有效性三个I期试验目标全部达到。
转化医学网:这两年内您的团队未做主动的宣传和报道,项目启动时被《Nature》新闻报道也是在意料之外。2016年10月临床实验开始后怎么就悄无声息了,大众都对此表示疑惑。今年2月发表在《SCIENCE》杂志Carl Juno团队的临床实验与我们有什么异同,他们晚了1年开始临床怎么文章先发表呢?
喻堃:首先,相同之处,都是在患者T细胞上进行了PD-1基因编辑。Carl June团队做的T细胞制品比我们多了一个TCR:1.增加了靶向性;2.但未来应用限制了适应症人群; 这个TCR是针对骨肉瘤上NY-ESO-1抗原的,由于TCR是有MHC限制的——简单的说某种HLA类型的人群才对该靶点抗原有反应,故而限制了适用人群。Carl June团队为了增加该外源性TCR在T细胞表面的表达,删除了两个内源性T细胞受体基因TCRα ( TRAC )和TCRβ ( TRBC ),同时将免疫检测点抑制基因PD-1删除了,避免T细胞被肿瘤细胞诱导凋亡。也就是说他们团队删除了三个基因,加入了一个基因。我们团队则认为PD-1才是免疫治疗的关键基因,且对细胞基因组改造越少,制品安全性稳定性越好。同时由于肺癌目前没有特异性好的靶点,以此对肺癌难以增加这类靶点操作。关于文章发表的情况,美国团队完成三例后立即在《科学》杂志就行了报导,我们希望按照GCP新药规范完成标准的I期临床试验,包括病例数量等,最后以一个完整的I期临床试验结果进行展示,为这方面的转化研究提供有益的基础。
所有12例受试者全部安全、未出现严重不良反应及脱靶;观察到的15项2级以内不良反应中,其中13项与抗癌明星药品PD-1单抗类似,间接证明编辑靶点效应;
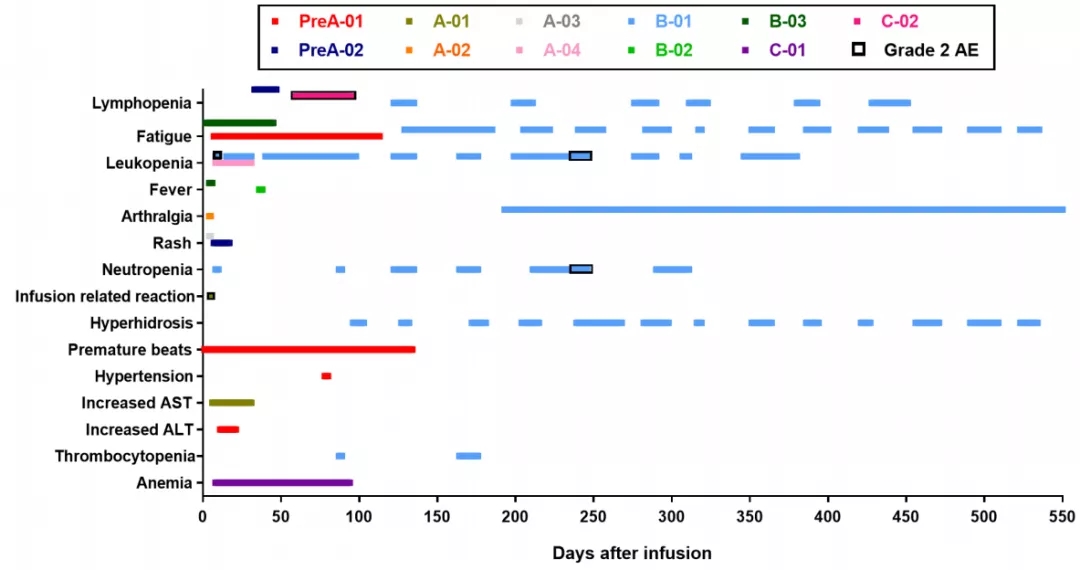
Fig. 主要不良反应与PD-1单抗类似
关于成都美杰赛尔生物科技有限公司
转化医学网:能否透露下你们下一步试验计划及该产品多久才能正式上市呢?
邓博:我们2016年开始第一例临床实验时细胞治疗是适用新技术法规监管的。由于我们对制品的工艺流程及用药方式可能会局部调整以期更好的临床效果,并适时启动IND申报,希望在II期并扩大适应症。相信有了前期夯实的临床实验基础我们能尽快推动该制品的产业化进程。
转化医学网:目前美杰赛尔除了这个PD-1删除T细胞产品外还有其他产品在研发吗?
邓博:美杰赛尔有两大类产品管线,一类是免疫细胞,另一类是干细胞。在免疫细胞大类下,我们除了有PD-1删除T细胞制品,还有通用型基因编辑免疫细胞制品等系列产品处于临床前阶段。
转化医学网:在今天采访结束前您们两位还有没有什么寄语要告诉读者朋友?
邓博:科技创新前途是光明的,道路是曲折的。我在纽约大学进行博士后研究时,我的导师美国科学院院士Ruth.Nussenzweig教授和合作导师之一Ralph Steinman教授(2011年诺贝尔奖得主,DC细胞的发现人)经常教导我们:You have to believe what you are doing。以此共勉。
基因编辑开拓者Jennifer A. Doudna在《自然》杂志发表评述:基因编辑技术用于许多疾病的临床治疗已经备受期待。这是改变医疗方案的重大机遇,是需要科学家、医生、生物伦理学家以及监管机构的精诚合作,以确保基因编辑在临床应用中的安全性、有效性的重要时代。这对很多病人来说影响巨大,刻不容缓。


关于成都美杰赛尔生物科技有限公司




(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发