新研究揭示胰腺癌的源起、转移以及如何提高疗效
| 导读 | “癌症之王”胰腺癌是一种恶性程度很高,诊断和治疗都很困难的消化道恶性肿瘤。胰腺癌早期的确诊率不高,手术死亡率较高,而治愈率很低。对此,医学工作者们一直在寻找对抗之法,这篇文章为大家带来最新的胰腺癌研究进展,我们共同学习! |
编辑:Echo
“癌症之王”胰腺癌是一种恶性程度很高,诊断和治疗都很困难的消化道恶性肿瘤,约90%为起源于腺管上皮的导管腺癌。其发病率和死亡率近年来明显上升。5年生存率极低,是预后最差的恶性肿瘤之一。胰腺癌早期的确诊率不高,手术死亡率较高,而治愈率很低。对此,医学工作者们一直在寻找对抗之法,这篇文章为大家带来最新的胰腺癌研究进展,我们共同学习!
糖尿病缘何导致胰腺癌?
随着对胰腺癌病因和发病机制研究的不断深入,人们发现糖尿病是胰腺癌发生的一个重要危险因素,但二者的相关性尚无明确定论。哥伦比亚大学的研究人员指出,糖尿病所致的内源性高胰岛素血症或才是胰腺癌的重要罪魁祸首之一。这意味着对胰腺癌合并糖尿病的患者来说,首要任务是解除胰岛素抵抗。
研究表明,胰岛素在体外或体内皆能促使胰腺癌细胞生长,高浓度胰岛素能使胰岛素样生长因子-1受体活化,产生包括细胞周期进程改变的生长促进效应。胰岛素抵抗及其介导的高胰岛素血症可通过激活胰岛素/胰岛素样生长因子受体信号通路促进细胞恶性增殖、侵袭及转移,诱使胰腺癌的发生发展。这说明胰岛素抵抗才是合并糖尿病的胰腺癌患者必须解决的头号难题。
为了进一步探索这一理论,研究人员将被敲除了胰岛素基因的小鼠与正常小鼠进行交叉对比,一年内持续喂食实验小鼠可升高胰岛素水平和促进胰腺癌发生的饮食。结果显示,因胰岛素基因被敲除导致胰岛素水平升高缓慢的小鼠胰腺癌的患癌率为0!此外他们还证实,小鼠体内胰岛素水平越低,小鼠患癌风险也随之降低。这项结果比之单纯的降糖操作效率大大提升。也就是说,糖尿病导致胰腺癌,都是胰岛素抵抗惹的祸!这一结果为胰腺癌合并糖尿病的治疗提供了新思路,为更多胰腺癌患者带来了新的希望。
“坏人”就藏在旁观者当中
胰腺炎是胰腺癌的最大危险因素,相关患者的癌变率比普通人高了2.7-16.5倍,且胰腺炎在炎症消退和抑制复发上暂无良方。前不久,美国冷泉港实验室的研究人员发现,聚糖CA19-9(glycan)竟是导致胰腺炎和胰腺癌的罪魁祸首。
长期以来,CA19-9都仅被定义为胰腺疾病的生物标志物,其是否在胰腺疾病的发生发展中有所作用犹未可知。本次研究中,实验人员利用转基因技术使小鼠表达人CA19-9,并充分提高小鼠血清中的CA19-9水平,结果发现与正常小鼠相比,基因工程改造的小鼠患上了严重的胰腺炎。此外,如果小鼠同时携带KRAS致癌突变,这些小鼠必将发展为胰腺癌。而进一步研究发现,使用CA19-9抗体则可以成功逆转这些小鼠的胰腺炎。
EGFR信号通路的异常与多种癌症的发生发展密切相关,胰腺癌自然也不能免其影响,研究人员指出,CA19-9可以引发表皮生长因子受体(EGFR)信号通路过度活跃。此外,CA19-9还可以修饰具有维持基底膜完整性和细胞外基质结构稳定性功能的基质细胞蛋白fibulin-3,进而引发癌变。而研究表明,CA19-9对fibulin-3的修饰还可以促进EGFR的异常活化。这显示CA19-9正是胰腺炎的始作俑者,也是胰腺炎所致的胰腺癌的罪魁祸首。而CA19-9抗体可以通过抑制EGFR异常激活的通路成功逆转胰腺炎,进而阻断胰腺癌的发生。
基质中“内奸”协助胰腺癌转移
胰腺癌基质主要由癌相关成纤维细胞(CAF)、免疫细胞和内皮细胞和其分泌的一些分子组成,占肿瘤组织近90%,而其中CAF又是绝大多数肿瘤基质的直接来源。澳大利亚Garvan医学研究所和Kinghorn癌症中心的研究人员发现,胰腺癌细胞对成纤维细胞进行“改造”使其重塑基质,并与其他侵袭性较小的癌细胞相互作用,从而增强肿瘤组织的侵袭能力。研究人员对比了转移性胰腺癌和非转移性胰腺癌的基质,并进行了混合实验,发现被“改造”的CAF除了保护协助肿瘤细胞外,还可以帮助肿瘤细胞“洗脑”其他同类,使得被“改造”的CAF越来越多,慢慢形成了既能保护癌细胞又能帮助其转移的微环境。而对CAF进行“改造”的,是一种叫做perlecan的蛋白。
perlecan即基底膜蛋白多糖,是正常基质的重要成分,但胰腺癌组织中的perlecan是由癌细胞分泌的。正是如此,perlecan才可以降低CAF的“戒心”对其进行“改造”,帮助促进胰腺癌的侵袭与转移。研究人员发现,降低perlecan的表达不仅可以遏制胰腺癌的转移,还显著提高了胰腺癌组织对化疗的反应性,这就意味着,可以借此开发出新的胰腺癌治疗方法。
针对胰腺癌的新型微管靶向药物
胰腺癌有一层很厚的结缔组织,阻碍了化疗药物进入肿瘤,也是胰腺癌是最难治癌症的原因之一。微管靶向药物(MTAs)已经是抗癌药物中最成功的一种,已经在白血病、淋巴瘤、乳腺癌、非小细胞肺癌以及胰腺癌等癌症中得到应用。
PCT596是一种小分子化合物,可抑制微管蛋白聚合。哥伦比亚大学的研究团队通过多种临床前研究模型,发现PTC596可递送到胰腺肿瘤组织,而且具有很好的耐受性,尤其是与一些一线疗法联合治疗有显著的疗效。其中,PTC596与紫杉醇联合使用时对于胰腺癌更加有效。
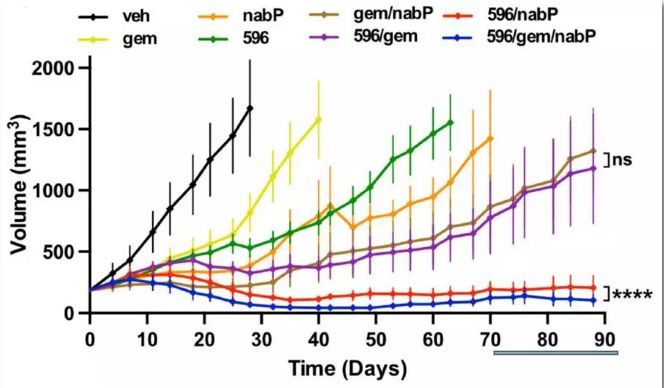
不同药物及药物联合条件下胰腺癌PDX模型肿瘤大小变化
(veh为对照组)
PTC596(PTC Therapeutics)是一种小分子抗癌药物,最早发现它对高表达BMI1蛋白的细胞系有很好的效果,相关临床研究也证明PTC596具有很好的耐受性。对PTC596的初步研究发现它可以强烈诱导多种PDA细胞系有丝分裂阻滞和凋亡。更重要的是, PTC596具有较长的半衰期,不会和p-糖蛋白(P-gp)结合,而且在胰腺肿瘤中有效的生物分布,是一种很好的候选药。
研究团队首先建立了一个具有间质结缔组织增生、化疗耐药等PDA重要特征的KPC小鼠模型。接着对PTC596进行了转录组学、细胞、生化方面的综合研究,发现PTC596通过直接抑制微管蛋白聚合来发挥作用,有别于其它的微管靶向药物(MTAs)。之后研究人员采用了基因工程KPC小鼠模型、患者来源癌细胞的移植瘤(PDX)等多种临床前研究模型,来证明PTC596联合一线药物治疗PDA的有效性。结果发现PTC596联合吉西他滨/紫杉醇,或者仅仅联合紫杉醇,均可使胰腺癌PDX小鼠模型达到持续缓解。说明这两种不同的微管靶向药物可以协同发挥作用。
研究揭秘胰腺癌患者“长寿”之谜
近日,在美国MD安德森癌症中心的研究者在Cell上发表的文章中,研究人员通过16S rRNA基因测序比对了胰腺癌“长寿”病人和一般短生存期病人的肿瘤组织样本,分析后发现生存期大于5年的“长寿”病人比一般短生存期的患者胰腺肿瘤组织内的细菌菌群的alpha多样性显著增高。进一步研究发现,肿瘤组织内特定的细菌菌群可以通过招募和激活细胞毒性T细胞改善抗肿瘤的免疫反应。
接着研究小组对肿瘤患者的肠道、肿瘤和邻近组织中的细菌进行了研究,发现肠道中的细菌可以在胰腺肿瘤中定植。将晚期癌症患者的粪便微生物群移植(FMT)到小鼠体后,发现供体微生物群约占最终肿瘤微生物群的5%,但整个肿瘤微生物群的70%已被移植菌群改变。在收集了长生存期和一般短生存期胰腺癌患者的粪便后,研究者将其通过FMT的方法分别移植到胰腺癌模型小鼠的方法,发现长生存期患者的粪便微生物可以有效的激活CD8+T细胞,显著延长小鼠的生存期。最终证明消化道细菌菌群可以定植到胰腺癌肿瘤内而影响肿瘤细菌菌群组成,从而调节免疫功能,最终改变患者的生存期。这一研究为肿瘤干预治疗提供了新的可能。
胰腺癌免疫治疗新曙光
胰腺癌免疫治疗效果堪忧,但7月初《科学转化医学》上发表的一篇文章为我们带来了好消息。华盛顿大学和芝加哥拉什大学的研究人员分析了胰腺癌的肿瘤微环境,发现了一种可以干扰骨髓源性细胞的迁移,进而显著抑制髓源性抑制细胞(MDSCs,肿瘤中广泛存在的肿瘤免疫反应相关细胞)、促进T细胞免疫反应的化合物(ADH-503)。研究显示,在胰腺癌小鼠中,MDSCs能够迁移至肿瘤部位并抑制抗肿瘤T细胞的功能,进而介导免疫逃逸,并在肿瘤来源细胞因子刺激下进行增殖,促进肿瘤生长。研究人员指出MDSCs的聚集能够促进肿瘤的发生和疾病进程,MDSCs的高表达与癌症患者的总体生存率降低密切相关。
对此,研究人员发现了一种名为ADH-503的化合物,其具有干扰骨髓源性细胞迁移的作用。将该化合物给予患有胰腺癌的小鼠后,他们发现肿瘤内和肿瘤附近的MDSCs数量下降,而且还保留了可以促进免疫反应的骨髓源性细胞,同时肿瘤杀伤性T细胞的浓度上升,肿瘤生长显著变缓,存活期也明显延长。进一步实验结果显示,单纯PD-1抑制剂治疗的小鼠收效甚微,小鼠在六周内死亡,而当免疫治疗与ADH-503联合应用时,肿瘤缩小,小鼠存活时间明显延长。这为“癌中之王”免疫治疗困局洒下了希望的种子。(转化医学网360zhyx.com)
参考来源:
1.CAF hierarchy driven by pancreatic cancer celp53-status creates a pro-metastatic and chemoresistant environment via perlecan.
2.Effective Delivery of a Microtubule Polymerization Inhibitor Synergizes with Standard Regimens in Models of Pancreatic Ductal Adenocarcinoma.
3. Endogenous Hyperinsulinemia Contributes to Pancreatic Cancer Development.Cell Metabolism.
4. Tumor Microbiome Diversity and Composition Influence Pancreatic Cancer Outcomes.
5. Agonism of CD11b reprograms innate immunity to sensitize pancreatic cancer to immunotherapies.
6. The glycan CA19-9 promotes pancreatitis and pancreatic cancer in mice.

 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发