改良基因魔剪助力精准治疗耳聋,我们离彻底攻克遗传性疾病还有多远?
| 导读 | 近几年来,CRISPR-Cas9系统在基因编辑领域可谓一直处于风暴中心的地位,给基因编辑领域带来了彻底性的变革,即便去年“基因编辑婴儿事件”的伦理问题引起全球轩然大波,但是基因编辑用于治疗遗传性疾病的探究却并没有止步。 |
作者:Paris
近几年来,CRISPR-Cas9系统在基因编辑领域可谓一直处于风暴中心的地位,给基因编辑领域带来了彻底性的变革,即便去年“基因编辑婴儿事件”的伦理问题引起全球轩然大波,但是基因编辑用于治疗遗传性疾病的探究却并没有止步。日前,哈佛医学院和波士顿儿童医院的一支联合研究团队,利用优化的CRISPR-Cas9基因编辑系统,在耳聋小鼠模型上精确识别并修正内耳的致聋突变,最终帮助小鼠保留听力,相关研究也同步在线发表在了顶尖学术刊物《Nature Medicine》杂志上,为无数遗传性耳聋患者埋下了希望的种子。

著名钢琴家贝多芬在32岁时听力完全丧失,其伤害不言而喻,他在留给其兄弟的遗嘱中写道,“正如落叶凋零,我的生命也已变得空洞。”
尽管贝多芬听力丧失的原因未知,但很多案例显示耳聋实际都和遗传DNA突变有关,而目前已知的和耳聋相关的基因有近100个。据流行病学调查显示,在每1000个新生儿中就有一位患有先天性耳聋,其中60%以上是由遗传因素引起的,遗传性聋的群体发病率已超过27/1000,在所有耳聋病人中,遗传性聋约占50%。这些数据听起来让人毛骨悚然,也吸引了越来越的科学家投身于遗传性耳聋治疗的研究。
今年1月份,Editas Medicine公司利用CRISPR基因编辑技术成功治愈了先天性失明,这是CRISPR基因魔剪在遗传病治疗领域的突破,也为遗传性耳聋的研究提供了新的思路。
研究发现,毛细胞要行使传导听觉信号的功能,离不开一种叫作TMC1的蛋白。当编码TMC1蛋白的基因发生突变,毛细胞会逐渐退化和死亡,导致听力丧失。某些遗传性耳聋患者在10~15岁开始逐渐失聪、到25岁左右完全丧失听力,正是因为TMC1基因突变。
有了先天性失明的成功研究,研究人员们信心十足,充满干劲,他们构建了一种疾病模型小鼠--”贝多芬小鼠”,这些基因突变小鼠会在出生一段时间后逐渐损失听力,到“青壮年”时完全失聪。和TMC1突变的耳聋患者一样,贝多芬小鼠体内的Tmc1基因仅仅出现了“一点”小错误:一个小小的碱基发生了变化。这意味着他们的基因编辑系统需要成功地在小鼠基因组的30亿个碱基字母中找出一个错误的字母。这无异于大海捞针呐。
工欲善其事必先利其器,好的工具是这项研究的关键,为了精确定位贝多芬小鼠的错误基因拷贝,同时不影响正常基因,研究团队在经典CRISPR-Cas9系统的基础上进行改良,分别对引导分子gRNA和内切酶Cas9都做了优化,这种gRNA引导Cas9酶到基因组所需编辑的位点上并在那里切割靶基因DNA序列。
随后,研究人员们将Cas9蛋白和gRNA一起包入了油脂液滴,并注射到了“贝多芬鼠”的幼鼠内耳中。一旦这些液滴与细胞接触,就会发生融合,将基因编辑的分子工具输送到细胞体内,定点修复突变。
这一疗法能顺利起效吗?在治疗的8周后,研究人员对“贝多芬鼠”的内耳在显微镜下进行了观察,他们发现,在未经治疗的贝多芬小鼠中,毛细胞随着结构的恶化逐渐消失;相比之下,接受治疗后的小鼠,保留了正常数量的毛细胞,结构完整或近乎完整。这与我们预想的无甚差别。
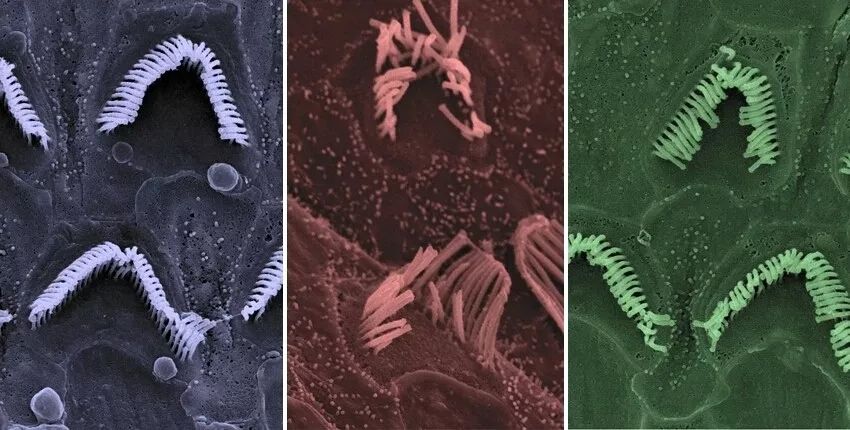
分别为正常毛细胞、贝多芬小鼠未经治疗时的毛细胞 、
经过治疗的毛细胞
当然,耳听为实,实践才是检验真理的唯一标准。随后,科学家们通过“听性脑干反应(ABR)”检查了小鼠的听力。这种测试方法检查不同强度声音刺激下的脑电波反应,意味着内耳中听觉细胞捕获到声音后把信号传到了大脑。这也是新生儿听力筛查的常用方法。
在不治疗的情况下,贝多芬小鼠通常在1个月大时就开始对高频声音反应降低,6个月大时完全失聪。相比之下,出生后不久就接受基因编辑疗法的小鼠,在2个月时与健康小鼠的听力几乎没有差别;到6个月大时,却对低频声音的听力仍保持正常,有些甚至对高频声音的反应也接近健康小鼠。更有甚者,在此后的近一年里保持了稳定的听力!
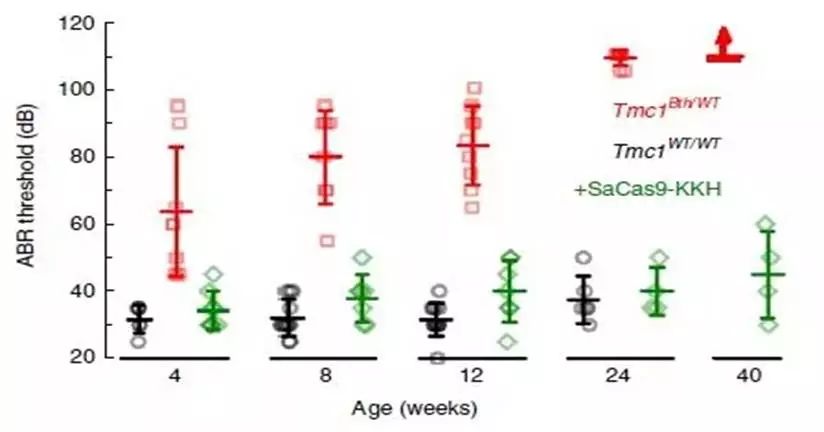
经过治疗的贝多芬小鼠几乎可以和正常小鼠一样听到低至30分贝左右的声音,相当于我们低声耳语的响度
研究人员不禁要欢呼起来,然而,科学是无比严谨的,安全性更是要寻求保障的。
随后,他们进行了DNA分析,结果显示,基因编辑活性只局限于在贝多芬小鼠的内耳细胞。而对正常小鼠做同样的“治疗”,没有在内耳细胞中检测到任何编辑变化,说明这种疗法没有干扰正常的基因功能,进一步说明了该工具的特异性。不仅如此,他们还给没有携带缺陷基因的小鼠施用了该疗法,小鼠没有表现出任何听力的损失。
在这项研究的最后,为测试该疗法在遗传性失聪患者上的治疗潜力,科学家们在一系列携带TMC1突变的人类细胞系上进行了实验。DNA分析显示,只有突变拷贝会被编辑,同一个细胞中的正常拷贝不会受影响。
这是继治疗先天性失明后,CRISPR基因魔剪在遗传性疾病治领域的又一突破,在一个多世纪前,人们首次将基因和疾病联系起来。随后,人们不断发现由单基因导致的疾病,至今数量已超过5000种。在CRISPR-Cas9等基因组编辑技术的帮助下,我们离矫正突变,治愈耳聋的目标又近了一步。这曲基因疗法谱就的乐曲,也是写给耳聋患者们的《欢乐颂》!(转化医学网360zhyx.com)
参考文献:
[1]Bence Gyorgy et al Allele-specific gene editing prevents deafness in a model of dominant progressive hearing loss.
[2]Giving Cas9 an ‘on’ switch for better control of CRISPR gene editing. https://news.berkeley.edu/2019/01/10/giving-cas9-an-on-switch-for-better-control-of-crispr-gene-editing/.
[3]https://www.nature.com/articles/s41591-018-0327-9
更多关于精准医疗相关新进展,请大家关注第三届现代临床分子诊断研讨会。
作为临床分子诊断领域重要学术研讨会,CMDF旨在为生物医学领域的专家、青年学者和企业精英提供一个交流平台。延续前两届 “讲述自己故事,创新分子诊断” 的大会主题,CMDF的与会者将能够充分交流学术意见,勇于碰撞思想火花,积极探讨生物标记物、诊治靶分子筛选、基因检测、微组学诊断、分子病理、医疗大数据、人工智能、新型诊断开发、疾病特异性分子诊断、生物标记物的药物研发、市场与法规等领域的关键问题。

长按识别二维码,立即报名
现在报名,可享受八折优惠哦
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发