肿瘤早筛界优等生:液体活检重磅研究集锦
| 导读 | 世界卫生组织提出,三分之一的癌症可以通过早期发现得到根治。通过规范化筛查早期发现并进行手术治疗,可以有效减轻癌症患者的痛苦和经济负担,因此,医学界格外看重癌症早期筛查。而近几年来液体活检技术的发展,让“滴血验癌”这种方法作为癌症早筛手段成为了可能。 |
世界卫生组织提出,三分之一的癌症可以通过早期发现得到根治。通过规范化筛查早期发现并进行手术治疗,可以有效减轻癌症患者的痛苦和经济负担,因此,医学界格外看重癌症早期筛查。而近几年来液体活检技术的发展,让“滴血验癌”这种方法作为癌症早筛手段成为了可能。
常规癌症筛查方法如胃镜、肠镜、组织活检等虽然应用广泛,但是却存在诸多问题,肠镜胃镜令人疼痛难忍,给患者身心造成负担;组织活检取样困难,且由于肿瘤的异质性往往难以做到取样完全,不利于诊断分型,又容易导致并发症。所以提到癌症筛查,许多人内心是抗拒的。
在细胞刚刚发生癌变但尚未形成癌灶之前,就会在体液(不仅包括血液,还有唾液、尿液、胸腹腔积液等)中出现一些游离的“破坏分子”——主要包括:循环肿瘤细胞(CTC)、循环肿瘤DNA(ctDNA)和外泌体等肿瘤来源的生物标志物。液体活检便是通过体外无创抽血的方式获取肿瘤脱落在血液中循环的ctDNA、CTC、外泌体等,以此来判断肿瘤的基因突变情况。相比传统肿瘤组织活检,液体活检具有许多优势,包括无创,可以多次取样,可同时检测多个肿瘤等等。
作为2015年十大科技突破之一、获得2017年新技术头名的液体活检在这几年里发展地如火如荼。今天就为大家对近一年来液体活检领域的重磅研究进展做一个盘点。
早期发现8大常见肿瘤
Detection and localization of surgically resectable cancers with a multi-analyte blood test.
去年年初,《科学》杂志发布了一项研究,美国约翰斯·霍普金斯大学研发了一种名为CancerSEEK的液体活检技术,可同时对八大常见肿瘤进行早期检测,中位敏感性达到70%,特异性达99%以上。研究者在最初选取的几百个基因和41个蛋白基础上进行了精简,最终锁定了16种肿瘤相关基因和8个肿瘤特异性蛋白,用计算机算法对结果进行分析。
CancerSEEK检测第一步是对16种肿瘤相关基因突变的检测,第二步是检测CA125、CEA、CA19-9、催乳素(PRL)、肝细胞生长因子(HGF)、骨桥蛋白(OPN)、髓过氧化物酶(MPO)、基质金属蛋白酶1(TIMP-1),这八种蛋白标志物。因为早期肿瘤并不能释放足够的可检出的循环肿瘤DNA(ctDNA),即使最敏感的检测方法也不能将其检出。结果显示,对812名无肿瘤病史的健康人群的检测中,这一检测的特异性在99%以上,只有7名健康对照者检测结果阳性。
至于敏感性,研究者用CancerSEEK检测了1005例未转移、未接受化疗的患有Ⅰ~Ⅲ期卵巢癌、肝癌、胃癌、胰腺癌、食道癌、结直肠癌、肺癌和乳腺癌患者血液标本。(这八大肿瘤贡献了美国近60%的肿瘤死亡病例,且前五种肿瘤目前没有有效的早检方法。) CancerSEEK检测对Ⅱ期患者的中位敏感性为73%,对Ⅲ期患者为78%,对Ⅰ期患者为43%。Ⅰ期肿瘤中,这一检测对肝癌的敏感性最高,达100%,最食管癌的敏感性最低,为20%。总体敏感性最高的是卵巢癌,为98%,乳腺癌最低,为33%。卵巢癌、肝癌、胃癌、胰腺癌、食管癌这五种尚无有效早检手段的肿瘤中,CancerSEEK检测的敏感性在69%~98%。除此之外,CancerSEEK可使63%的患者可精准确定肿瘤位于哪个系统,83%的患者可将肿瘤病灶锁定在两个之内。
适用于胶质瘤的液体活检
Tracking tumour evolution in glioma through liquid biopsies of cerebrospinal fluid
今年1月底,美国纪念斯隆凯特琳癌症中心Ingo K. Mellinghoff 和Michael F. Berger团队在Nature上发表了一项研究,证明了脑脊液(CSF)中肿瘤DNA的序列可以重演出胶质瘤进展过程基因组的演进。这种液体活检方法是可以反复、动态地监测胶质瘤的变化;因此有望替代脑组织的穿刺活检,进而帮助胶质瘤患者制定更好的治疗方案。
研究人员通过腰椎穿刺对85名胶质瘤患者的脑脊液进行了取样,在近一半的患者中检测到了肿瘤来源DNA。进一步研究发现,脑脊液中胶质瘤来源DNA序列的测序结果与组织活检的非常类似,也包含大量突变。而且,在所有检出的样品中均检测到IDH1等胶质瘤发生早期的突变及1p/19q的联合缺失。虽然并不是所有类型的胶质瘤都会将DNA排入到脑脊液,但根据检测到的DNA仍然可以作为胶质瘤早期诊断的指标。
研究人员同时提取了另外19名胶质瘤患者的CSF ctDNA与血浆cfDNA并进行基因测序。他们发现这些患者的ctDNA中都至少存在一个胶质瘤相关基因突变,而84%患者的cfDNA并未检测到任何突变,这意味着CSF的ctDNA序列库比血浆更加丰富,也证明CSF ctDNA检测具有较强的灵敏性。
胶质瘤的基因组在疾病发展过程中会不断演变,监测它的进展要求反复进行组织活检;因此深入研究脑脊液中肿瘤源性物质将有助于胶质瘤的早期诊断和复发监测,从而实现肿瘤治疗个体化精准治疗。
血浆TMB可以稳定预测免疫治疗效果
Blood-based tumor mutational burden as a predictor of clinical benefit in non-small-cell lung cancer patients treated with atezolizumab
去年8月份,加州大学戴维斯分校综合癌症中心David R. Gandara和基因泰克公司David S. Shames领衔的联合研究团队,在Nature Medicine发表重要研究成果,他们首次证实血浆中肿瘤突变负荷(bTMB)(每百万碱基中被检测出的基因点突变和插入缺失突变个数)可以准确重复测量,并且与免疫检查点抑制剂疗效相关。
他们首先开发了一套在血液中检测TMB的技术方案(bTMB),接着用两个Tecentriq(PD-L1抑制剂)治疗非小细胞肺癌的临床研究做了回顾性研究,经过一系列运算分析得出结论:bTMB确实能够作为Tecentriq免疫治疗的潜在非侵入性生物标志。这项研究证实了血浆TMB对免疫治疗药物疗效预测的有效性,即通过检测bTMB可以很好的预测患者能否从PD-L1抗体治疗中获益。
ctDNA片段特征初露端倪,早期肿瘤检测将更加灵敏
Enhanced detection of circulating tumor DNA by fragment size analysis
血液中的肿瘤循环DNA分子含量极低,这使得其检测非常困难,特别是在癌症的早期阶段。去年11月,英国剑桥大学科学家Nitzan Rosenfeld及其团队公布了一项研究,他们发现了血液中循环肿瘤DNA和非肿瘤DNA片段的长度分布特征,找到了一种更灵敏的血液中肿瘤DNA检测方法。此研究发表在Science Translational Medicine 上。
一般来讲,通过加大测序深度可以提高ctDNA检测的灵敏度和准确率,但是由于非肿瘤来源的DNA中可能会带有肿瘤相关的突变,所以加大测序深度可能会带来假阳性的结果。这限制了液体活检的应用。此前的研究表明,不同细胞释放的cfDNA的长度会有所不同,这也许可以作为区分cfDNA来源的信号。这种cfDNA片段长度之间的差异,极有可能是辨别肿瘤细胞与非肿瘤细胞的重要手段。如果真是这样,解决肿瘤液体活检面临的问题将指日可待。但是,之前的此类研究结果未能解释肿瘤细胞的DNA长度为什么会不同,这使DNA片段的长度特征信号无法准确地代替肿瘤cfDNA。
以此为背景,研究者们在体外富集了血浆中特定片段长度的cfDNA,进行测序后,对不同片段区间的cfDNA都进行了分析。他们结合已知的突变位点,通过机器学习算法去寻找更加精细的规律,得到了一个人工智能模型。用这个模型在区分肿瘤血液样本和健康血液样本时,曲线下面积达到0.994,相当令人震撼!而未富集的普通cfDNA检测,曲线下面积只有不到0.8。从已有效果来看,这种富集方法可以使液体活检在更早期更加灵敏地检测到癌症。
全基因组分析助力癌症早期筛查
去年的AACR上,GRAIL公司公布了一项研究结果,通过对血液里游离的肿瘤DNA进行全基因组测序分析,在一组已知早期疾病患者中,65%的人被检出患有肿瘤,且假阳性率极低。研究者对新诊断出癌症的878名患者和580名非癌症患者对照组的血液样本进行了三种不同的检测,并且分析了整个基因组DNA。其中一项检测筛出了500种已知的癌症基因突变,第二种检测到基因拷贝数异常,第三组分析了DNA甲基化。此外还验证了每一种检测方法对癌症的预测效果。对于196位患有胰腺癌、肺癌、卵巢癌、肝癌和食管癌五种高侵袭性且难以早期检测的癌症,甲基化检测效果最好, 65%的患者在癌症没有扩散到淋巴结以外的其他器官时就被检测出。
对于已转移的癌症,正如所预期的那样,由于患者的肿瘤更大,转移到多个器官中,并在血液中释放更多DNA,因此,对转移性癌症的检出率更高,可达95%。
GRAIL的三项测试假阳性率都很低,在580名非癌症患者对照组中只有5人被检测为阳性。
允许捕捉单个ctDNA的液体活检技术
Isolation of circulating tumor cellsin non-small-cell-lung-cancer patientsusing a multi-flow microfluidic channel
今年3月,来自伊利诺伊大学芝加哥分校(UIC)和澳大利亚昆士兰科技大学的研究小组发表的一篇文章指出,他们开发了一种新型的多流微流体(MFM)系统,其可分离高纯度的循环肿瘤细胞。这一系统内的微通道利用细胞的惯性迁移。细胞的侧向迁移在很大程度上取决于这一系统内微通道中细胞的大小。由于其利用的是循环肿瘤细胞的物理特性,因此无需利用亲和力和其他黏附活性手段来进行繁琐复杂的分离工作。这一系统最大的特点是实现了对来自白细胞的循环肿瘤细胞进行了无标记分离。
在完成系统设计与建造后,研究人员对系统的流出率和流量等分析数据进行了详细研究。当研究人员将10个肺癌细胞加入5毫升健康血液样本再通过他们的设备运行检测血液时,它能够使用微流体装置发现原先93%的癌细胞。先前开发的分离循环肿瘤细胞的微流体装置仅具有50-80%的回收率。
此外,当研究团队运行8个非小细胞肺癌患者血液样本时,他们能够利用微流体装置从6个样本中分离出癌细胞。除了高效率和可靠性外,这套系统仅需少量血液样本稀释液也是其另一个亮点。利用微通道分析8个NSCLC患者和5个健康受试者的血液样本时,研究者可从6名患者的样本中分离出循环肿瘤细胞,且每毫升血液中最多检测出78个癌细胞,并且在健康对照中未发现癌细胞。因此,这套系统显示了超高的分离效率(> 99%)和分离纯度(> 87%)。接下来,研究者将通过大样本量来进一步验证该系统的可靠性,并为最终走向临床应用提供可靠的实验数据。
人工智能助力液体活检
Genome-wide cell-free DNA fragmentation in patients with cancer
前不久,《自然》刊登了一篇约翰霍普金斯大学医学院科学家们研究癌症液体活检方面的一篇文章。他们基于血浆中的游离DNA,开发了一个人工智能平台,能够准确区分癌症患者和健康人的血液样本,准确率达到91%。此外,这个平台还能辨别肿瘤DNA的来源,准确率达到75%。研究者对236名癌症患者以及245名健康人的血浆游离DNA进行测序,将已知的肿瘤特异突变标记肿瘤来源的ctDNA与序列的同源健康人游离DNA进行比较,发现两者的片段长度分布呈现出不同的模式。所有健康人的游离DNA片段长度分布都非常规律。而同源序列的ctDNA片段长度分布却显得杂乱无章。
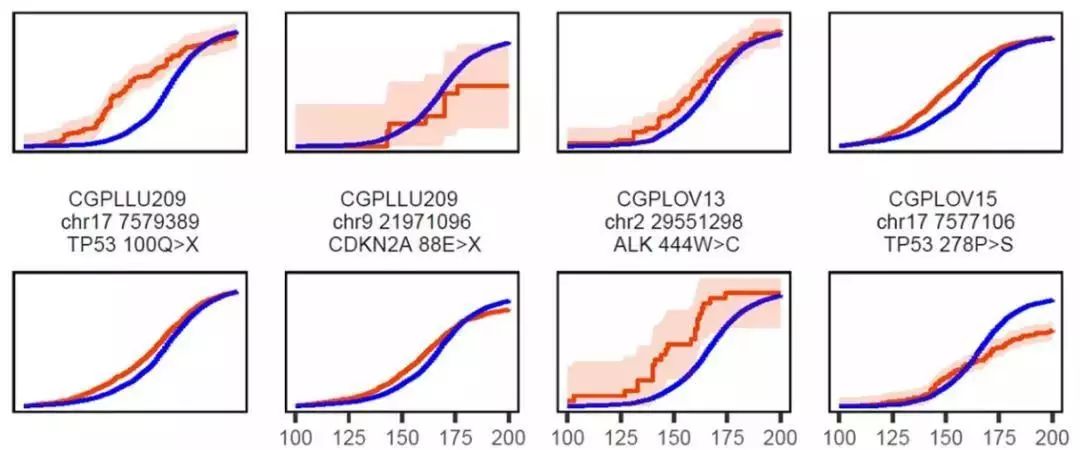
蓝色为正常细胞,红色为癌细胞
这表明,根据游离DNA的片段长度分布模式就可以将健康人和肿瘤患者区分开来。
要获得更加准确的结果,还需要借助人工智能。 研究者构建了一个人工智能平台DELFI,然后利用游离DNA的片段长度特征及突变等位基因等其他变量,对肿瘤病人和健康人进行区分,结果发现DELFI对癌症患者进行判断时准确率有91%,而健康人的准确率达到98%。此外,DELFI还能区分游离DNA的来源,不过准确率仅为61%。
液体活检优点:
肿瘤筛查:即通过对非固态生物组织(血液、唾液、尿液)检测肿瘤细胞CTC、肿瘤DNA筛查肿瘤。
肿瘤分期分级:循环系统是肿瘤转移的重要途经,将外周血CTC计数和染色体作为临床分期的参考条件,可增进对肿瘤分期的理解,有利于医生制定肿瘤方案。
预后评估:血液CTC含量变化可以帮助医生判断患者接受治疗的效果、耐药情况从而制定相应的调整方案。
精准用药:同一种癌症,突变可能不同,对不同药物反应各异,分析血液ctDNA可以帮助医生判断肿瘤突变类型,制定个体化用药方案。
耐药监控:患者接受治疗后,会出现耐药情况,过去只能在化疗随诊时才能回顾性评价,且传统组织活检只能检测肿瘤组织局部区域,不能反应肿瘤的动态变化。外周血ctDNA突变类型的变化,可能是实时检测肿瘤药物耐药的一种有效方法。
肿瘤转移、复发:多数肿瘤如若能在早期检测到转移、复发将会影响治疗结果。检测血液CTC、ctDNA可以补充传统影像学早期预警灵敏度和及时性的不足。
液体活检是一个热点领域,近来研究远不止上述这些,所以小编只能挑选其中较为重磅的研究呈现给大家,后续还会继续关注~另外,第二届上海国际癌症大会今年十月份要召开,届时,研究者们将对免疫治疗、肿瘤微环境、肿瘤标志物等主题进行热烈讨论,欢迎大家一起来聆听、分享自己的研究进展和见解~(转化医学网360zhyx.com)

(识别二维码进入报名入口)

 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发