深度好文 | 带你了解亨廷顿舞蹈症研究现状
| 导读 | 近年来,亨廷顿舞蹈症的机制及潜在治疗方法的研究取得了突破性进展,并且为类似疾病(例如阿尔兹海默氏症、帕金森氏症等)的研究提供了思路。 |

作者:Carrie
近年来, 亨廷顿舞蹈症的机制及潜在治疗方法的研究取得了突破性进展, 并且为类似疾病(例如阿尔兹海默氏症、帕金森氏症等)的研究提供了思路。本文主要从亨廷顿舞蹈症的发病机制出发,对亨廷顿舞蹈病的研究现状做一个概述。
神经退行性疾病(neurodegenerative disorders)是一类引起中枢神经元进行性死亡丧失进而逐渐导致神经系统功能障碍直至崩溃的严重疾病。其多见于中老年人, 造成巨大的社会负担。随着中国老龄化加剧, 神经退行性疾病研究的重要性也与日俱增。
目前研究最多的神经退行性疾病主要有阿尔茨海默氏症(Alzheimer’s disease, AD)、帕金森氏症 (Parkinson’s disease, PD)、肌萎缩侧索硬化(amyotrophic lateral sclerosis, ALS)和亨廷顿病(Huntington’s disease, HD), 并称四大神经退行性疾病。然而迄今为止, 国内外都没有发现治本的方法。
近年来, 亨廷顿舞蹈症的机制及潜在治疗方法的研究取得了突破性进展, 并且为类似疾病(例如阿尔兹海默氏症、帕金森氏症等)的研究提供了思路。本文主要从亨廷顿的发病机制出发,对亨廷顿舞蹈病的研究现状做一个概述。
HD是一种功能获得型基因突变引起的遗传病
HD是一种常染色体单基因显性遗传病, 由HTT基因序列的突变引起。单基因突变引起疾病的根本原因可能是突变基因产物功能丧失(功能丧失型), 或者突变基因产物获得新的功能(功能获得型)。区别两者是进一步研究疾病机制及可能治疗策略的前提。
在小鼠遗传学模型中获得的实验证据表明, HD主要是一种功能获得型疾病, 主要证据体现在两个方面。首先, Htt基因的缺失(敲除)并不能引起HD 的类似表型。Htt的完全敲除在小鼠中尽管胚胎致死, 但没有引起神经特异的死亡, 与HD细胞表型不一致。杂合敲除小鼠基因Htt或者利用基因编辑技术敲除四月龄以上的成年小鼠的Htt并未引起HD相关表型。另一方面, 表达变异HTT基因的转基因小鼠, 在保留原有野生型HTT基因表达的情况下, 仍然导致HD相关表型。近年来针对野生型HTT(wtHTT)的条件敲除的研究则表明, wtHTT的丧失也可能会通过影响选择性自噬等引起细胞毒性, 参与疾病发生, 但绝大部分证据依然指向HD是功能获得型疾病。
可溶性mHTT蛋白是导致HD的主要源头
变异HTT基因表达的变异HTT蛋白(mHTT)具有神经毒性, 从而导致HD。而近期研究发现, 变异HTT基因表达的RNA可能通过重复序列非ATG起始的翻译(RAN-translation)产生除了变异HTT蛋白之外的其他带氨基酸重复的蛋白(包括带polyAla、 polySer、polyLeu和polyCys的蛋白), 而这些蛋白的表达可能也会引起细胞毒性, 参与疾病的发生。
除了蛋白之外, 变异HTT基因表达的RNA, 由于具有对应的GUC重复序列, 也可能通过相变(phase transition)等机制引起毒性, 参与疾病的发生。 但这一假说目前还缺乏可靠的功能性证据。尽管近年来发现了以上这些可能参与HD产生及发展的新的源头分子, 但绝大部分证据依然指向mHTT是HD产生的主要源头。因此, mHTT为何产生神经毒性最终导致HD是疾病机制研究的核心问题。
近年来的证据表明, 可溶性的mHTT蛋白是导致疾病的主要种类。首先, 可溶性mHTT 会引起内质网应激、线粒体自噬、氧化应激等毒性细胞反应。与此一致, 可溶性mHTT而非mHTT聚集体, 与多个转录因子存在相互作用。更加直接的证据来自于针对细胞死亡的直接研究。HD大鼠神经元在没有不可溶mHTT聚集体形成时已发生死亡, 并且死亡时间与可溶性mHTT的水平显著相关。可溶性mHTT可能是产生细胞毒性导致HD的主要蛋白。因此, 可溶性mHTT中过长的polyQ导致细胞毒性的结构基础, 是回答HD源头分子机制的关键问题。
mHTT蛋白中polyQ构象的“多态性”
mHTT中polyQ的构象多态性
引起的降解异常可能是导致HD的源头
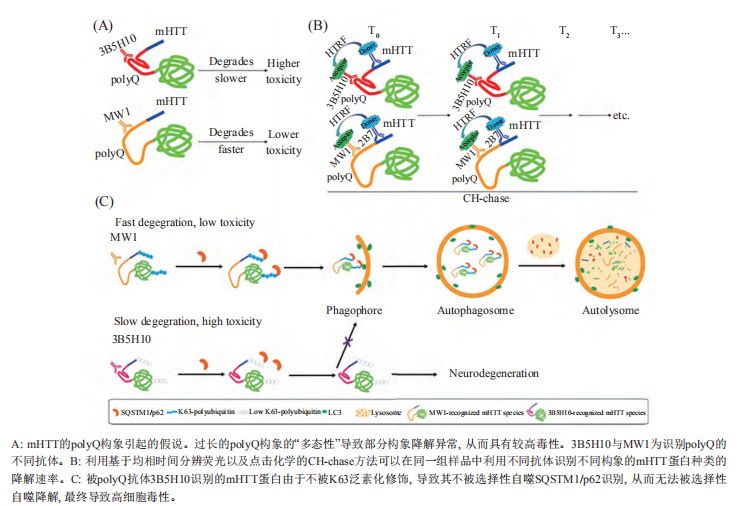
针对过长的polyQ导致细胞毒性的构象基础,依然缺少能够直接阐述的结构生物学数据这一问题。近期的一项研究从一个崭新的角度—蛋白质降解入手。一方面, 如果相同细胞的同一蛋白有着不同的降解速率, 意味着该蛋白存在不同的构象; 另一方面, HD神经元中, mHTT的降解速率与其神经毒性呈非常显著的负相关, 即mHTT降解越慢, 其毒性越大。因此, 降解速率较慢的构象可能具有更高的毒性。
通过一种新建立的基于点击化学和均相时间分辨荧光的蛋白降解速率测量方法CH-chase, 研究人员发现, polyQ抗体3B5H10所识别的mHTT构象的降解速率明显低于其他polyQ抗体所识别的构象的降解速率, 从而直接证明了不同polyQ类型的存在。进一步研究发现,HD患者大脑组织和细胞中, 该构象的赖氨酸63型泛素化几乎缺失, 因此无法被选择性自噬接头蛋白p62识别, 从而无法被选择性自噬降解, 从而降解速率减缓, 导致较高毒性。因此, mHTT中过长的polyQ构象存在多态性, 导致构象依赖的不同的降解速率, 浮现了降解较慢的“毒性构象”, 进而可能产生细胞毒性, 导致疾病。
mHTT产生毒性的下游分子机制
mHTT通过其下游分子信号通路导致细胞毒性, 从而诱发疾病。临床上HD的一些表现可能与mHTT产生毒性下游分子机制密切相关。例如, HD的起病年龄(age of onset)被发现与mHTT的polyQ长度(即变异HTT基因的CAG重复数)呈显著的负相关, 但其中的机制不明。
研究人员在一系列表达含有不同CAG重复数的HTT基因的小鼠模型中通过转录组研究发现, 特定转录组的“模块(module)”在HD 纹状体及皮层中与野生型有差异, 且这种差异随年龄而加剧。更有趣的是, 其中部分模块(例如纹状体中的13个功能模块)的差异随年龄而加剧的速度与CAG重复数呈正相关。因此, CAG重复数越大, 引起转录组功能模块变化的速度越快, 因此起病越早, 从而解释了上述临床表现。
HD以及其他神经退行性疾病的另一个临床表现, 是其疾病蛋白水平以及症状严重程度随着时间不断增加。最近的研究揭示了mHTT可以通过增加下游激酶HIPK3的表达以及激酶MAPK11的活性, 正向调控其本身的水平, 从而对自身水平形成正反馈调控, 解释了mHTT随时间积累的可能分子机制。这可能为mHTT随时间积累聚集以及HD疾病症状的进行性发展提供了可能的解释。
HD的脑区特异性
HD主要由HTT基因突变产生的mHTT蛋白的细胞毒性引起。mHTT在各种细胞中广泛表达, 但HD中神经退行主要发生在大脑纹状体, 而纹状体中表达多巴胺二型受体(D2)的中间多棘神经元 (medium spiny neuron)在HD病人中最早死亡。 为何HD存在这种脑区异性也是领域关注的重要问题, 而阐明这种脑区特异性的本质有助于在细胞及神经环路层面理解疾病机制。
HD脑区特异性的产生主要有两类可能的机制。一类是细胞自主性机制(cell autonomous), 即纹状体神经元高表达某些特异基因, 放大了mHTT的毒性或者使得此类神经元对mHTT毒性更加敏感, 最终使得这些神经元在疾病中更容易退行死亡。例如, 纹状体富集表达的小G蛋白Rhes, 可能通过增加mHTT的苏木素化(SUMOylation)增加其毒性导致纹状体神经元死亡。研究者发现, 纹状体富集的孤儿G蛋白偶联受体GPR52可以特异性增加纹状体mHTT的水平, 导致纹状体神经元的特异性死亡。
另一类可能的机制是非细胞自主性机制(non-cell autonomous), 即纹状体神经元接收了其他类型细胞传递的信号而特异性死亡。 在BACHD小鼠模型中, 特异性关闭mHTT在纹状体的表达, HD相关表型依然存在并只有很微弱的改善, 而特异性关闭mHTT在皮层的表达, 则几乎完全拯救了该模型中各种HD的相关表型。此外, 近年来一些研究也表明, 皮层到纹状体的神经环路投射及BDNF分泌可能对HD的脑区特异性有重要贡献。由于小鼠模型的主要表型体现在神经功能方面, 神经退行表型非常微弱, 因此上述结论需要更好的模型和测试加以验证, 而脑区特异性产生的真实机制是细胞自主性机制和非细胞自主性机制的协同作用。
综上所述, 自HD致病基因HTT发现以来, HD产生的遗传学机制、生化机制、下游分子机制以及脑区特异性机制的研究均有重要突破。其中, HD的下游分子以及细胞/脑区层面发病的机制更接近疾病的临床表现, 针对性治疗可能相对容易, 但不易治本。mHTT本身则更接近疾病产生的根源, 针对性治疗更难, 但更可能获得治本的疗法。(转化医学网360zhyx.com)
参考文献:中国细胞生物学学报 Chinese Journal of Cell Biology 2018, 40(10): 1621–1632 DOI: 10.11844/cjcb.2018.10.9002
往期精彩推荐
第三届现代临床分子诊断研讨会

作为临床分子诊断领域重要学术研讨会,CMDF旨在为生物医学领域的专家、青年学者和企业精英提供一个交流平台。延续前两届 “讲述自己故事,创新分子诊断” 的大会主题,CMDF的与会者将能够充分交流学术意见,勇于碰撞思想火花,积极探讨生物标记物、诊治靶分子筛选、基因检测、微组学诊断、分子病理、医疗大数据、人工智能、新型诊断开发、疾病特异性分子诊断、生物标记物的药物研发、市场与法规等领域的关键问题。
(识别二维码报名,6月30日前报名半价!)

 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发