肺癌诊断中的基因甲基化到底是个啥?
| 导读 | 结果显示痰样本的甲基化分子标志物仍需进一步筛选以获得更高的检测灵敏度[10]. 分子诊断时代已经来临目前,肺癌以及其它各种癌... |
 作用机理
作用机理
基因甲基化是指DNA分子上CpG双核苷中的胞嘧啶(C)在酶的作用下选择性地添加甲基形成5'-甲基胞嘧啶的过程。CpG双核苷常位于基因转录调控区附近,其甲基化能引起染色质结构、DNA构象、DNA稳定性等发生改变,从而调控基因的转录和表达。
简单来说,基因甲基化就像DNA的一顶最神奇的“帽子”。戴上这顶“帽子”则会封锁转录起始使转录过程不能延伸,并且影响转录因子与启动子的结合,从而使得基因沉默。因此低甲基化会激活基因转录,而超甲基化则会阻止基因转录导致基因沉默。
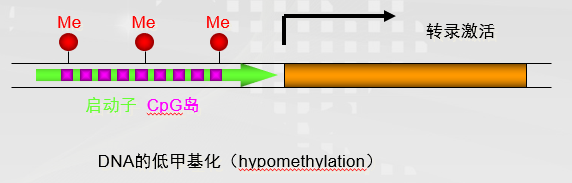
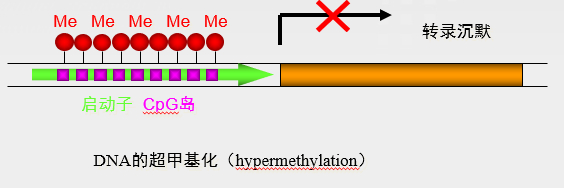
基因甲基化异常是肿瘤发生最常见的表观遗传变化之一,肿瘤的发生表现为基因组整体甲基化水平降低(癌基因)和CpG岛局部甲基化水平的异常升高(抑癌基因)。
肺癌与基因甲基化的关系,早在2005年,德国海涅大学的Schmiemann等人就已发现在肺癌患者中存在RASSF1A、APC、p16(INK4a)等基因的甲基化状态异常,于是提出了利用甲基化检测来进行肺癌早期诊断[1]。
理想很丰满,但是怎么把这些“戴帽子”的基因找出来呢?原来DNA 经亚硫酸盐处理后, 非甲基化的胞嘧啶转变为尿嘧啶, 而甲基化的胞嘧啶保持不变。PCR扩增后再利用测序、基因探针等方法即可鉴别扩增的DNA种类,找出“戴帽子”的基因。这就有了甲基化特异性PCR(MS-PCR)、荧光定量法(MethyLight)等技术。而随着涉及到基于特定基因甲基化的肺癌早期诊断等研究日益增多,甲基化也成为肺癌诊断的新型分子标志物。
已发现的一些肺癌相关的甲基化特异基因[2]
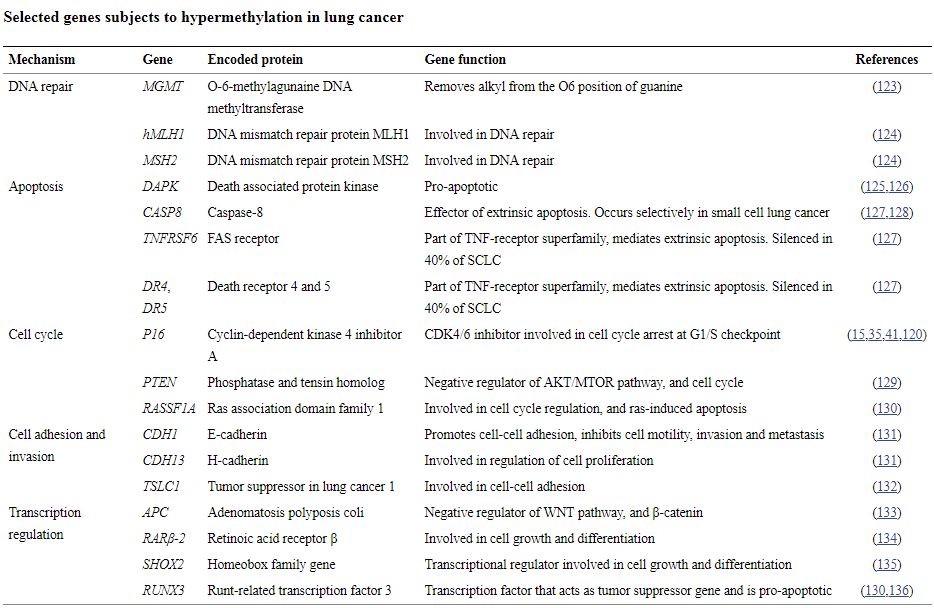
这一系列肺癌相关的甲基化特异基因中,SHOX2和RASSF1A研究较为深入。前者作为一个常见的转录调控因子,后者作为一个抑癌基因,其甲基化水平的高低影响着肿瘤发生的进程。
01SHOX2:矮小同源盒基因( Short Stature Homobox 2),在胚胎形成期对骨骼、心脏和神经系统的发育作用重大,在肺癌、乳腺癌和肾癌等中异常表达。研究发现SHOX2甲基化能较好的区分肺部良恶性病变,灵敏度和特异性分别为60%和90%(样本类型:血清)。SHOX2不仅可以作为肺癌早期检测的标志物,而且其甲基化还可以作为非小细胞肺癌(NSCLC)预后的独立预测指标[3]。
RASSF1A:02Ras相关区域家族1A(Ras-association domain family 1A),其调控的靶基因涉及基因转录、信号转导、细胞骨架、细胞周期、细胞黏附及凋亡等多方面,作为一个抑癌基因,在肿瘤发生及发展过程中的作用尤为重要,其启动子超甲基化状态是导致其在肺癌组织频繁失活的重要原因。研究表明,在非小细胞肺癌(NSCLC)癌组织和癌旁组织中RASSF1A的甲基化率分别为55%和10%,并随肺癌的进展而逐渐升高[4]。

SHOX2和RASSF1A基因甲基化
在肺癌诊断中的应用
目前,SHOX2和RASSF1A双基因甲基化联合检测不再停留在理论阶段,而是作为新型分子标志物投入到实际的临床诊断中。
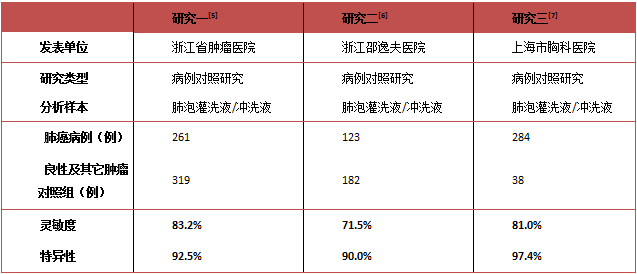
浙江省肿瘤医院、浙江大学医学院附属邵逸夫医院、上海市胸科医院基于肺癌早期诊断目的,采用肺部特异性较高的样本(肺泡灌洗液/冲洗液)进行双基因甲基化检测,结果发现联合检测这两个基因的甲基化水平,对肺癌有很高的检测灵敏度和特异性(表1)[5-7]。
表1.SHOX2和RASSF1A双基因甲基化检测肺癌
同时,SHOX2和RASSF1A双基因甲基化对于不同分期的肺癌都有很高的检测灵敏度,尤其是对于早期的肺癌患者(图1)。对于不同类型的肺癌(如鳞癌、小细胞肺癌等)也有很高的灵敏度(图2)[5-7]。
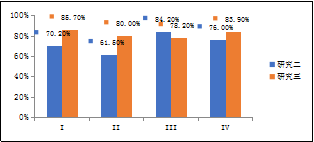
1 各分期肺癌样本检测灵敏度
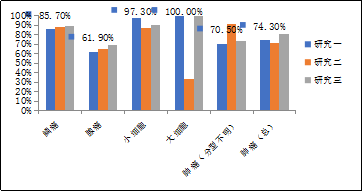
图2 各类型肺癌样本检测灵敏度
另外,SHOX2和RASSF1A双基因甲基化与细胞学方法进行联合检测时,能够弥补细胞学检测灵敏度低的缺陷(图3)。两种方法联合检测,能够有效避免肺癌漏诊,特别是在细胞学检测结果未明或阴性时(图4)[5-7]。
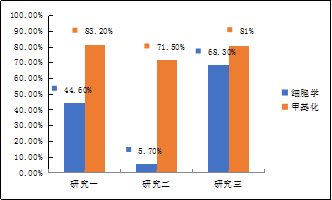
图3各研究细胞学与双基因甲基化检测灵敏度比较

图4 130例肺癌样本的细胞学结果及双基因甲基化结果[5]

SHOX2、RASSF1A基因甲基化
在其它样本类型中的应用
SHOX2、RASSF1A基因甲基化对其它样本类型的检测也有相关研究报道。
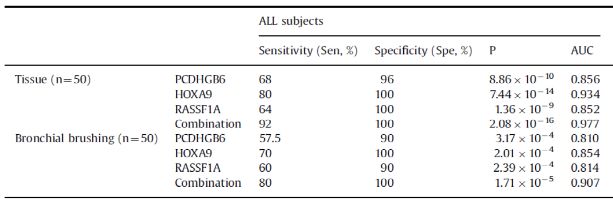
中山医院和中科院上海微系统与信息技术研究所对50例早期非小细胞肺癌(NSCLC)患者样本进行甲基化检测,结果显示RASSF1A单基因甲基化检测对癌组织的灵敏度为64%,对支气管刷检样本的灵敏度为60%。如果联合另两个基因共同检测(PCDHGB6、HOXA9),灵敏度会分别达到92%和80%[8]。
德国Weiss等人对118例肺癌患者和212例对照的血浆样本进行SHOX2和PTGER4双基因甲基化联合检测,结果显示当特异性为90%时,灵敏度为67%;当灵敏度为90%时,特异性为73%[9]。
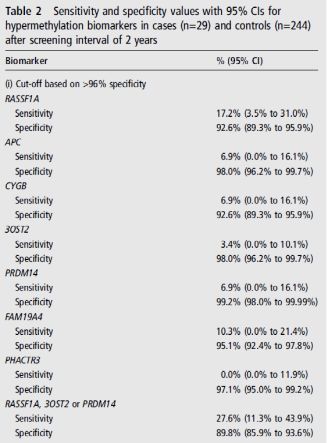
荷兰VUUniversity Medical Center对56例肺癌患者和219例对照的痰样本进行7个基因的甲基化检测(RASSF1A、APC、cytoglobin、3OST2、FAM19A4、PHACTR3、PRDM14),并对这些痰样本做了细胞学检测(细胞学结果全部为阴性)。结果显示痰样本的甲基化分子标志物仍需进一步筛选以获得更高的检测灵敏度[10]。
 分子诊断时代已经来临
分子诊断时代已经来临
目前,肺癌以及其它各种癌症的发病率急剧上升,虽然传统病理检查仍是各种肿瘤诊断的金标准,但是传统病理在一些情况下已不能满足临床诊断早期、准确、快速的需要。分子诊断从核酸及核酸修饰的水平(DNA/RNA、DNA甲基化等)检测细胞和组织的分子遗传学变化,以协助病理诊断和分型、指导靶向治疗、预测治疗反应及判断预后等,开启了诊断学发展的新纪元。
现在,越来越多的甲基化分子标志物正在被探索和发掘,以用于肺癌等各种癌症的早期诊断和鉴别诊断。若干甲基化标志物甚至已被开发成成熟的试剂盒推向了肿瘤诊断市场,如SHOX2和RASSF1A甲基化用于肺癌诊断、Septin9甲基化用于结直肠癌诊断。同时,拓展更多样本类型的研发工作也在不断进行。如何在保证样本特异性和灵敏度的前提下,尽量使用创伤程度低、病人痛苦少、易于获取的样本,该工作的重要性甚至不低于新标志物的筛选。令人可喜的是,SHOX2和RASSF1A双基因甲基化在组织、胸水、痰液中的肺癌检测效能已在正式评估中,在血液等其它样本中的应用也已做了小样本测试,并会陆续公布。
当下,分子诊断时代已经来临,未来的病理报告也将会是形态学诊断和分子信息整合型的报告。分子诊断与传统病理联合检测、相得益彰,为患者带来的是无限希望,为医生带来的则是早期诊断、精准治疗水平的提升,一个崭新的时代已经开启!

参考文献
[1] HeichmanKA, Warren JD. DNA methylation biomarkers and their utility for solidcancer diagnostics. Clin Chem Lab Med, 2012, 50(10): 1707-1721.
[2] Junaid Ansari, Rodney E. Shackelford, Hazem El-Osta. Epigeneticsin non-small cell lung cancer: from basics to therapeutics. TranslLung Cancer Res 2016;5(2):155-171.
[3] Kneip C, et al. SHOX2 DNA methylation is a biomarker for the diagnosis oflung cancer in plasma. J Thorac Oncol, 2011 Oct; 6(10):1632-1638.
[4] 杨振华,蔡映云,孙丽华等.p16 INK4a和RASSFla启动子甲基化在非小细胞肺癌中的研究[J].实用肿瘤杂志,2007,22(2):153-155.
[5] 张毅敏,王明丽,吴杰等.肺泡灌洗液中SHOX2和RASSF1A基因甲基化联合检测对肺癌的诊断价值.Journalof Chinese Oncology,2016,22(12):1032-1036.
[6] RenM.P., et al. Methylation analysis of SHOX2 and RASSF1A inbronchoalveolar lavage fluid for early lung cancer diagnosis. Annalsof Diagnostic Pathology 27(2017): 57-61.
[7] ZhangC.Z., et al. DNA Methylation Analysis of the SHOX2 and RASSF1A Panelin Bronchoalveolar Lavage Fluid for Lung Cancer Diagnosis. Journal ofCancer 8(2017) 17:3585-3591.
[8] Y.Ma,et al. A panel of promoter methylation markers for invasive andnoninvasive early detection of NSCLC using a quantum dots-based FRETapproach. Biosensors and Bioelectronics. 85(2016): 641-648.
[9] G Weiss, et al. Validationof the SHOX2/PTGER4 DNA Methylation Marker Panel for Plasma-BasedDiscrimination between Patients with Malignant and Nonmalignant LungDisease. Journal of Thoracic Oncology. 2017,12(1) :77-84.
[10] HubersAJ, et al. DNAhypermethylation analysis in sputum of asymptomatic subjects at riskfor lung cancer participating in the NELSON trial: argument formaximum screening interval of 2 years.J Clin Pathol. 2017,70:250-254.
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发