再下一城!佰美基因又一个三类IVD产品获NMPA准产批件
| 导读 | 2018年12月26日,陕西佰美基因股份有限公司自主研发的IVD产品《人CYP2C19基因分型检测试剂盒》获得国家药品监督管理局(NMPA,NationalMedicalProductsAdministration)准产批件,取得医疗器械产品注册证。 |
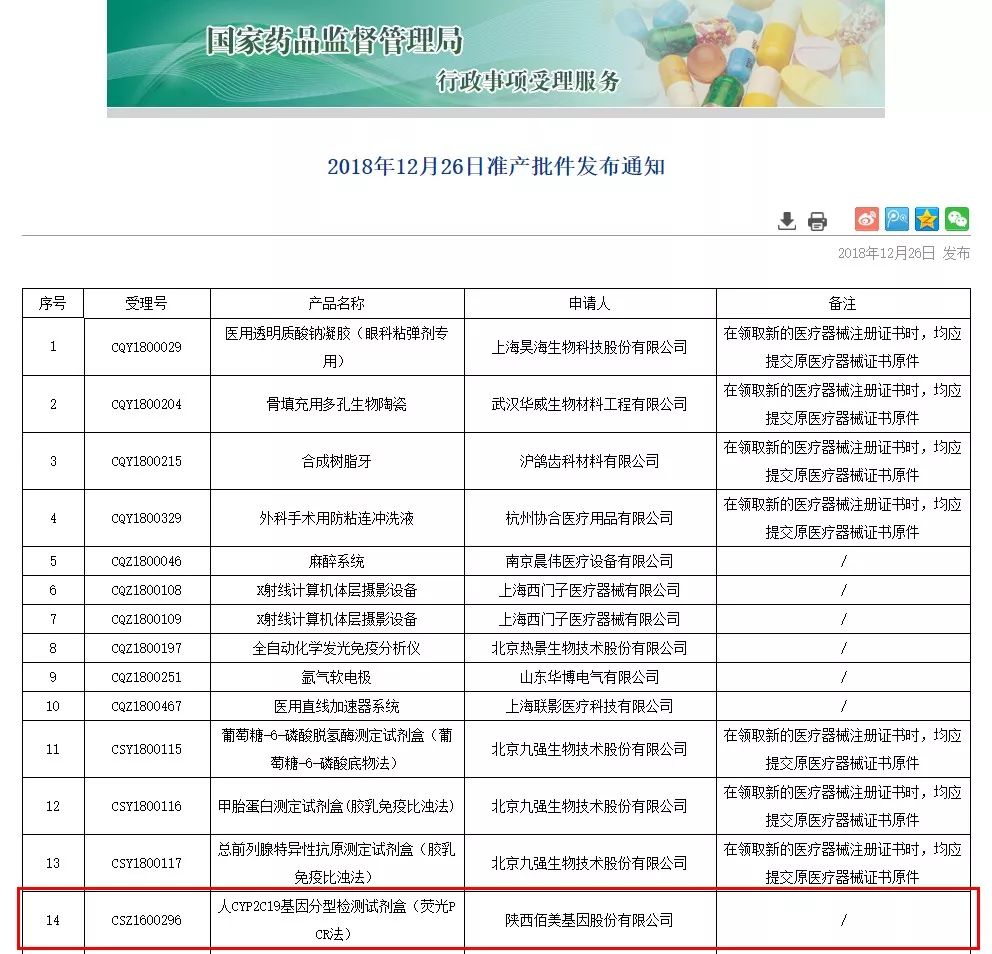
2018年12月26日,陕西佰美基因股份有限公司自主研发的IVD产品《人CYP2C19基因分型检测试剂盒》获得国家药品监督管理局(NMPA,National Medical Products Administration)准产批件,取得医疗器械产品注册证。这是继12月18日佰美基因《人MTHFR基因分型检测试剂盒》获批后的第二个三类医疗器械注册证书。
该IVD产品上市后,应用于体外定性检测人DNA样本中CYP2C19 基因*2 (c.681G>A) 及*3 (c.636G>A) 两种基因的多态性,其检测结果可指导氯吡格雷临床用药。氯比格雷作为抗血小板凝集类药物,在临床上广泛应用于预防动脉粥样硬化血栓形成,如心肌梗死、急性冠脉综合征、经皮冠状动脉介入术后置入支架患者、溶栓等治疗。
大量研究表明CYP2C19基因多态性与氯吡格雷治疗心血管疾病的疗效及毒副作用密切相关。携带CYP2C19*2(c.681G>A)或*3(c.636G>A)的患者较携带野生型等位基因的患者对氯吡格雷的敏感性较低,且治疗后再发心血管事件的几率更高。通过CYP2C19基因检测,判断患者对相关药物的代谢能力,可以指导临床用药方案的制定,实现精准用药治疗。
据悉,该项目于2014年9月在中国中医科学院西苑医院、贵州省人民医院、无锡市中西医结合医院开展临床试验研究,通过临床试验数据证实,产品与对比试剂检测结果符合率高度一致;2017年2月,通过陕西省药品监督管理局质量管理体系核查;2017年8月,通过国家局审评中心组织的专家会审评;2018年1月,在空军军医大学补充开展了药物-基因检测联合评价系列临床试验,进一步证实了该基因检测的临床意义和价值。
该类试剂盒属于三类医疗器械,是体外诊断试剂中注册申报难度最高的产品种类。此前,佰美基因《人MTHFR基因分型检测试剂盒》于2018年12月18日已获得NMPA准产批件。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发