外泌体:肿瘤免疫的双刃剑
| 导读 | 随着测序技术的不断发展,癌症的体液活检技术逐渐壮大。除了CTC和ctDNA,其中的后起之秀外泌体越来越受到关注,尤其是在癌症领域,凭借其分布广泛,含量高,结构稳定的特点,在肿瘤诊断(早筛)与监测以及治疗方面(如新型生物标志物、靶向治疗等)都表现出了巨大的优势。 外泌体究竟是什么?外泌体(exosomes)最早是指细胞内多泡体(MV |
随着测序技术的不断发展,癌症的体液活检技术逐渐壮大。除了CTC和ctDNA,其中的后起之秀外泌体越来越受到关注,尤其是在癌症领域,凭借其分布广泛,含量高,结构稳定的特点,在肿瘤诊断(早筛)与监测以及治疗方面(如新型生物标志物、靶向治疗等)都表现出了巨大的优势。
外泌体究竟是什么?
外泌体(exosomes)最早是指细胞内多泡体(MVB)与细胞膜融合后,释放到细胞外基质中的一种直径约30~120nm 的膜性囊泡,现特指直径在40-100nm的盘状囊泡。在1983年之前一直被认为是细胞用来排泄废物的工具,后发现其可随着循环系统到达其他细胞或组织内,并将亲本细胞的大量生物分子运载至其他细胞,其中包括如蛋白质、核酸(miRNA、mRNA、lncRNA、circRNA、DNA等)、脂类等。这些内容物赋予了外泌体多种多样的生物学功能,如细胞间的信息传递、免疫中的抗原呈递,肿瘤的生长与迁移等。
外泌体介导的肿瘤免疫逃逸及耐受
研究发现肿瘤细胞可以通过大量生产外泌体,利用这些外泌体将癌基因转移至其他细胞,并改变其原始环境提前建立适合自己转移并扎根的微环境,除此之外还可传递能抑制针对肿瘤的免疫应答的信号因子,来降低肿瘤病人尤其是晚期病人的免疫力。
我们都知道,肿瘤免疫逃逸及耐受等一直在困扰着肿瘤研究者。由此看来,肿瘤细胞来源的外泌体(tumor-derived exosomes,TDEs)是其中一个不可忽视的原因。
外泌体介导肿瘤免疫耐受
免疫耐受是肿瘤细胞逃避免疫监视的主要原因,exosome介导的免疫耐受与其含有的肿瘤相关抗原和免疫抑制分子相关,这些免疫分子能够下调免疫系统的表达。TDEs还能传递某些抑制信号,在机体免疫应答过程中起负性调节作用,诱导肿瘤细胞形成免疫耐受。有研究表明,TDEs诱导的免疫耐受与其表面FasL相关联,Fas存在于多种细胞表面,当机体受到外界刺激后,Fas含量迅速上升,并通过Fas/FasL途径诱导细胞死亡,以此来调节免疫应答以及维持免疫耐受。
另外,髓源性抑制细胞(MDSCs)是骨髓来源的一群异质性细胞,是树突状细胞(DCs)、巨噬细胞和(或)粒细胞的前体,具有显著抑制免疫应答的能力。研究人员发现肿瘤来源的exosomes(TDEs)携带的HSP72通过激活STAT3抑制了MDSCs的免疫抑制作用,从而达到免疫耐受。
外泌体介导肿瘤免疫逃逸
关于肿瘤免疫逃逸,其中一个原因是那些能够促进癌转移的蛋白质和RNA可以利用外泌体作为逃逸载体而免受机体免疫应答作用。而且在肿瘤微环境中,外泌体也可在肿瘤细胞、免疫细胞以及基质细胞之间相互传递,充当通讯员的作用,帮助肿瘤细胞逃避免疫监视。
再者,有研究显示,TDEs还可以充当炮灰角色,替代肿瘤细胞接受免疫系统的攻击,帮助肿瘤细胞实现免疫逃避,外泌体可以说是相当的“忠诚“了。
最新的研究发现,黑色素瘤细胞分泌的外泌体中带有PD-L1蛋白,并且可以直接与T细胞结合,抑制T细胞的功能,导致T细胞在到达癌细胞做斗争之前出现“疲劳”。这个研究结果已成为目前肿瘤免疫逃避的新见解。
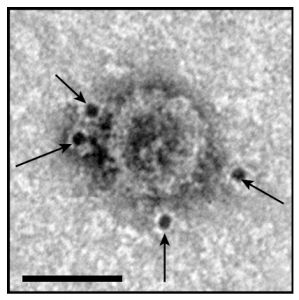
黑色素瘤细胞分泌的携带PD-L1的外泌体
外泌体与肿瘤免疫治疗
外泌体是一把双刃剑。
由于大多数细胞都可分泌外泌体,肿瘤细胞可以,那么免疫细胞当然也可以。而且免疫细胞来源的外泌体可以抑制肿瘤的生长、增殖和转移。
研究发现,抗原提呈细胞(APC)分泌的exosome可以刺激T细胞的体外增殖和诱导体内的抗肿瘤免疫反应。从肿瘤细胞中分泌出的包含肿瘤抗原的exosome也可以通过APC交叉呈递给细胞毒性T淋巴细胞(CTL),使其产生肿瘤杀伤作用。因此,exosome作为一种潜力巨大的肿瘤疫苗,目前也得到了广泛的研究。
此外,包括上文中提到的黑色素瘤中带PD-L1蛋白外泌体,它不仅仅是解释了为什么肿瘤患者的免疫系统会减弱,更重要的是揭示了为什么PD-1靶向治疗对70%的黑色素瘤患者没有效果,对当前火热的抗PD-1/PD-L1免疫疗法具有重要指导意义,是迈向精准、个性化医疗的又一大步。
而且,根据不同细胞来源的外泌体不同,研究人员已经提出了通过检测循环中外泌体的方法来预测哪些癌症患者会对某些检查点抑制剂药物产生反应,这样不仅可以精准治疗,还可以追踪这些疗法的有效性。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发