【干货】NGS多基因检测试剂盒获批上市,大步迈入精准医疗时代!
| 导读 | 7月23日,广州燃石医学检验所宣布获得CFDA批准基于高通量测序(NGS)以及伴随诊断标准审批的多基因突变联合检测试剂盒(EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒可逆末端终止测序法),将用于帮助非小细胞肺癌患者精准选择靶向药物治疗。8月13日,CFDA通过创新医疗器械特别审批通道,批准了诺禾致源人EGFR/KR |
7月23日,广州燃石医学检验所宣布获得CFDA批准基于高通量测序(NGS)以及伴随诊断标准审批的多基因突变联合检测试剂盒(EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒可逆末端终止测序法),将用于帮助非小细胞肺癌患者精准选择靶向药物治疗。
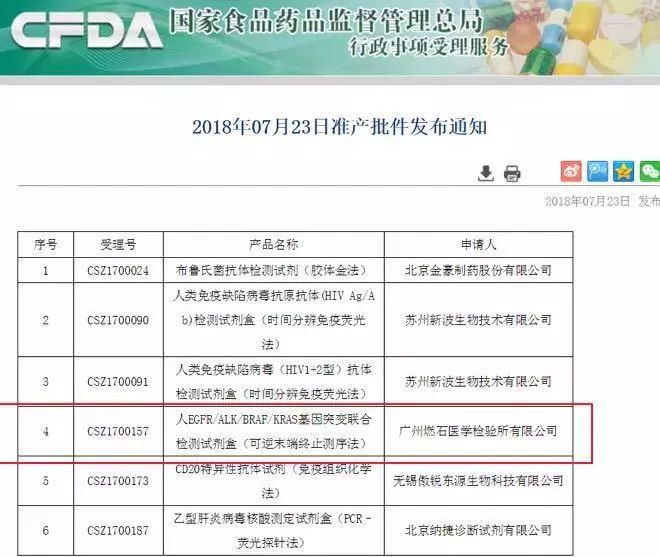
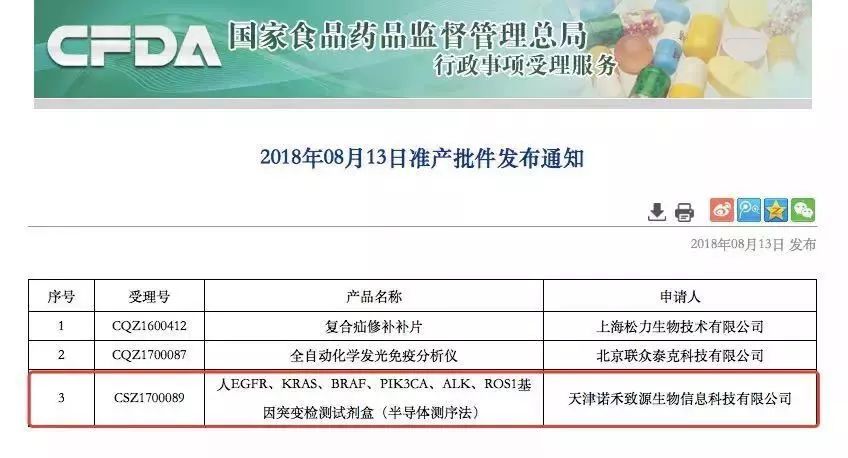
8月13日,CFDA通过创新医疗器械特别审批通道,批准了诺禾致源人EGFR/KRAS/BRAF/PIK3CA/ALK/ROS1基因突变检测试剂盒(半导体测序法)的III类医疗器械上市。该产品批准用于检测非小细胞肺癌(NSCLC)患者肿瘤组织中与靶向治疗密切相关的六个基因的突变状态,筛选适合接受靶向药物治疗的患者。
8月14日,为进一步规范肿瘤相关突变基因检测产品的注册申报和技术审评,提高审评效率,统一审评尺度,国家食品药品监督管理总局和医疗器械技术审评中心发布关于公开征求《肿瘤相关突变基因检测试剂(高通量测序法)性能评价通用技术审查指导原则(征求意见稿)》意见的通知。

CFDA如此快速的审批通过基于高通量测序(NGS)试剂盒产品,毋庸置疑的是对精准医疗领域的重视,投射出对NGS技术所带来的技术革命的无限期许。
说到下一代测序NGS技术不得不提到人类基因组计划,要知道第一次人类基因组测序大约耗费了3000万美元和十年的时间,通过长时间测序技术的发展,下一代测序NGS技术的出现对于人类基金组计划有着里程碑式的意义。
现在人类基因组测序成本降低至1000美元并且只需一到两天的时间,测序所需要的时间和成本相较于第一次人类基因组测序相比得到了极大的降低,这一种颠覆性的技术出现使得科研工作者都能以较少的经费,测取数以百万计的短DNA序列数来进行各方面的研究应用。可以说下一代测序NGS彻底改变了人类基因组的测序方法,为临床诊断开启了新的大门。
在临床应用领域NGS技术的低成本和高速度,从根本上促进了个性化医疗时代的到来,据估计,下一代测序NGS技术的全球市场在2020年预计会达到87亿美元,年复合增长率达到20%。北美和欧洲虽然占据了最大的市场份额,但是发达市场已趋近饱和,亚洲显然具着巨大机会。
国内外重点布局精准医疗领域
纵观近期CFDA批准的上市肿瘤靶向药物。6月Opdivo上市和7月Keytreda两款免疫检查点PD-1抑制剂的快速获批上市,创下了中国进口抗肿瘤生物制剂的最快审批记录,国家对抗癌药物的审批大开绿灯标志着我国正快速步入了精准医疗的时代,而伴随诊断正是精准医疗的基石。而研究表明,超过55%的携带癌症相关基因突变的患者可能被漏检,采用新型分析方法,扩大癌基因检测的范围,势在必行。
2015年1月20日,美国总统奥巴马在国情咨文中提出精准医学计划,希望医学可以引领一个医学新时代,3年过去了美国都做了哪些事?
2016年12月19日
FoundationMedicine的FoundationFocus™ CDxBRCA完成与Clovis的Rubraca® (rucaparib)临床试验。2016年12月19日,Rubraca获批用于携带BRCA致病突变(同时包括胚系和体系突变)卵巢癌患者的三线及以上治疗,FoundationFocus™ CDxBRCA也同时拿到PMA(Premarket Approval)批文,成为第一个获批的NGS伴随诊断产品。BRCA1/2基因的突变没有明显的热点突变而且还有多种突变类型,除了常见的SNV、Indel,也包括Large Rearrangement这样的外显子水平的结构变异,常规一代测序方法并不能涵盖以上多种突变类型,而NGS检测却可以检测BRCA基因的全部外显子,并通过生信算法完成对各种突变类型的分析。Rubraca与FoundationFocus™ CDxBRCA的这一种Codevelopment也是FDA批准CDx的典型代表,即药物与诊断同步研发、同步提交、同步获批。
2016年5月
《自然医学》杂志公布了由美国最好的癌症中心发布的全球首个万人晚期癌症测序成果,这是基于二代测序技术的大数据肿瘤遗传变异项目,或开启癌症诊疗新模式。
2017年6月23日
FDA批准赛默飞Oncomine DX Target Test,突破了原有的“One CDx, One Treatment”升级为“One CDx, Three Treatments”。Thermo Fisher的Oncomine DX Target Test包含23个基因,其中BRAF、ROS1、EGFR基因分别获批用于NSCLC患者对Tafinlar+Mekinist® (dabrafenib with trametinib)、XALKORI® (crizotinib)、IRESSA® (gefitinib)药物治疗方案的选择,多个有明确治疗意义的生物标志物被整合到一个CDx中,用于相应治疗药物的选择,是FDA批准的第一个可筛查多个标志物的肿瘤二代基因测序检测。
2017年6月29日
FDA批准Illumina公司开发Extended RAS Panel对KRAS/NRAS基因明确的56个突变进行IVD检测,用于Amgen公司Vectibix(panitumumab)在mCRC治疗中药物的选择。相比于之前的RAS基因检测,这一检测扩展到NRAS基因,并对codon12/13之外的突变位点进行检测,串联起从文库制备、测序以及临床报告生成的全流程分析,依然发挥了NGS可以检测更多明确位点的优势以及Illumina作为上游仪器试剂公司的整合能力。
2017年11月15日
FDA批准了IMPACT研究无疑具有划时代的意义。该检测是对实体瘤患者组织样本的468个基因全部外显子和特定内含子进行深度测序、通过生信流程进行突变分析和微卫星不稳定MSI分析,结合MSKCC开发的OncoKB数据库对检测数据进行解读。我们在回顾看MSKCC的之前发表的文章时不难发现,这一检测经过大量的验证(Validation)及质量控制(Quality Control),并在数据解读中对基因突变按照临床意义及证据等级进行划分,保证测序过程及数据解读的准确可信。除了已知的临床意义明确的基因意外,这一IVD产品包括大量相对未有明确临床意义,但可以增加我们对患者肿瘤认识的基因及其突变,这无疑是FDA在NGS监管领域的又一大突破,具有划时代的意义。
2017年11月30日
FDA批准了FoundationMedicine的旗舰产品FoundationOne CDx,也就是之前FoundationFocus™ CDxBRCA的母体检测,用于非小细胞肺癌、黑色素瘤、乳腺癌、结直肠癌、以及卵巢癌的临床诊疗。该检测分析实体瘤患者FFPE样本的324个基因多种突变及特定融合,并进一步分析两个基因组学特征——MSI和TMB,检测结果可用于指导15种靶向药物的临床使用。这一检测是通过FDA最新颁布的Breakthrough Device法案获得上市许可的第一个IVD产品。以上两个大型panel的获批也标志着“One IVD, more Treatments”时代已经到来。同期还批准了美国医疗保险和医疗救助服务中心CMS的保险覆盖,监管和医保部门推动肿瘤免疫治疗基因检测市场化进程的决心可见一斑。
16、17年FDA以前所未有的速度批准了多个基因检测技术用于临床,近期,CFDA连续1个月内接连通过燃石、诺禾致源的癌症多基因检测试剂盒产品,都意味着基于NGS的伴随诊断方案获得了国家、医学临床层面对肿瘤多基因panel检测在临床上实用性的认可。
近些年来,尽管基因检测的话题一直非常火热,但实际落地,进入临床的产品却很有限,仅限于无创产前诊断、试管婴儿等生殖健康领域。NGS的伴随诊断方案的获批,意味着基因检测行业有了一个新的产业增长点。
基于NGS的伴随诊断代表着分子诊断从单突变、单基因的诊断向多基因、同时检测多个位点多个基因的大panel、大数据将成为一种新趋势。大panel的高覆盖精准检测和诊断,能够找出具有临床意义的致病突变,可以指导癌症靶向治疗、免疫治疗以及癌症预后评估,从而实现真正的个体化精准治疗。
同时庞大的数据可以支持大规模的回顾性研究,找出确定新的肿瘤生物标记物和对靶向治疗敏感的基因突变,对肿瘤基因的大规模测序也为科研和新药开发及临床试验奠定了基础,可以对用药敏感性、耐药性、病人筛选等提供重要依据。最后,我们有理由相信随着医疗的进步以及测序成本逐渐降低,肿瘤患者会得到更好的治疗,甚至痊愈。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录



还没有人评论,赶快抢个沙发