【药研发】0803 弯道超车成功!信立泰替格瑞洛获批 | 我国首个干细胞新药完成...
| 导读 | ≥50%且铂类化疗后无效的复发或转移性头颈部鳞状细胞癌(HNSCC)的成人患者.5. 第一三共白血病新药获FDA突破性疗法认定.... |
今日头条
弯道超车成功!信立泰替格瑞洛获批。信立泰的替格瑞洛已确认获批,成为国内替格瑞洛的首仿药。替格瑞洛是阿斯利康(AstraZeneca)研发的口服新型 P2Y12 受体拮抗剂,通过抑制血小板激活而发挥抗凝血作用,于 2012 年 11 月进入中国,其化合物专利到期日为 2019 年 12 月2 日。2017 年,信立泰的替格瑞洛接连挑战原研专利成功(意味着信立泰的替格瑞洛获批上市就可销售);而后,又以首仿为由纳入优先审评。目前,国内替格瑞洛在研厂家多达 38 个,仅片剂,就有正大天晴、科伦药业等 11 家企业申报上市。
国内药讯
1. 新版《医疗器械分类目录》已正式实施。国家药监局发布《关于加强医疗器械生产经营许可(备案)信息管理有关工作的通知》,要求自2018年8月1日起,新发放的医疗器械经营许可证和第二类医疗器械经营备案凭证的经营范围应当分为原《医疗器械分类目录》分类编码区和新《医疗器械分类目录》分类编码区,并明确标识。 新《分类目录》参考《欧盟公告机构用框架目录》的结构,主要以技术领域为主线,更侧重从医疗器械的功能和临床使用的角度划分产品归属。
2. 我国首个干细胞新药完成临床研究。北京协和医院“干细胞的新药研发及临床转化研究”北京市重点实验室赵春华团队研发的干细胞新药将向国家药监局递交申请我国第一个干细胞新药证书。该新药迄今已在北京大学人民医院、北京协和医院、解放军301医院等国家临床药理基地开展了11年临床研究,完成了产品的临床安全性及有效性试验,且总体有效率达到88.9%。
3. 三叶草「 依那西普生物类似药 」国内Ⅰ期临床入组首例受试者。三叶草生物制药宣布在中国进行的SCB-808的Ⅰ期临床试验入组首例受试者。该试验旨在评估通过皮下注射SCB-808和原研药Enbrelâ(依那西普)的药代动力学特性、安全性和免疫原性。SCB-808是一种预充填小容量注射液Enbrelâ的生物类似药,用于治疗类风湿性关节炎和其他自身免疫性疾病。
4. 来凯医药获诺华两款抗癌药物的全球独家授权。来凯医药(Laekna)宣布与诺华(Novartis )公司签署一项合作协议,以获得诺华两款口服泛AKT激酶抑制剂抗癌药物afuresertib(ASB183)和uprosertib(UPB795)的全球独家权利。目前,这两个药物处在I/II期临床研究中,用于多种癌症的治疗,由诺华从葛兰素史克(GSK)处购买获得。此次交易,诺华除了获得前期费用和发展里程碑付款之外,还将获得来凯医药科技有限公司的股权。而去年双方曾就用于前列腺癌的CYP17抑制剂(CFG920)达成全球许可协议。
5. 华润医药调整收购江中药业股份价格。8月1日,江中药业发布公告称,已收到《华润医药控股有限公司关于要约收购江中药业股份有限公司股份事宜进展暨要约价格调整》的函。内容显示,华润医药控股拟通过增资与购买江中集团部分股权相结合的方式取得江中集团不低于 51%股权,成为其控股股东。本次要约收购所需最高资金总额为人民币 42.02亿元。
国际药讯
1. 辉瑞Xeljanz治疗溃疡性结肠炎获欧盟批准上市。辉瑞(Pfizer)公司宣布,欧盟委员会(EC)已批准其口服抗炎药Xeljanz(tofacitinib),用于对常规疗法或生物制剂反应不足、不再反应、或不耐受的中度至重度溃疡性结肠炎(UC)成人患者的治疗,用药方案为10mg剂量每日2次(BID)治疗组至少8周,之后是5mg BID(每日两次)或10mg BID。此次批准,使Xeljanz成为欧盟获批用于该患者群体的首个也是唯一一个口服疗法和JAK抑制剂。
2. 灵北&大冢精神病药物Rxulti获欧盟批准上市。日本大冢(Otsuka)制药与灵北(Lundbeck)制药联合宣布,欧盟委员会(EC)已批准Rxulti(brexpiprazole,依匹哌唑)用于精神分裂症成人患者的治疗。双方计划在2019年上半年将Rxulti推向欧洲市场。一项长期维持(预防复发)研究数据显示,与安慰剂组相比,Rexulti治疗组病情复发的时间显著延长(p<0.0001)。Rxulti是一种每日一次的第二代(非典型)口服抗精神病药物,由大冢发现,后经灵北和大冢联合开发。
3. 辅助治疗黑色素瘤!百时美Opdivo获欧盟批准上市。百时美施贵宝(BMS)公司宣布,欧盟委员会(EC)已批准其PD-1免疫疗法Opdivo(纳武单抗,nivolumab),作为一种辅助药物,用于存在淋巴结受累或转移性疾病且已行完全切除术的黑色素瘤成人患者的治疗,该适应症也适用于BRAF突变型和野生型黑色素瘤。III期临床研究CheckMate-238的数据显示,针对已完全切除的IIIB/C期或IV期黑色素瘤患者,与Yervoy相比,Opdivo将疾病复发风险显著降低35%(p<0.0001);Opdivo治疗组18个月无复发生存率达66.4%,而Yervoy组为52.7%,达到研究的主要终点。
4. 默沙东Keytruda联用化疗药获CHMP的推荐批准。默沙东(MSD)PD-1疗法Keytruda获欧洲药品管理局(EMA)人用药品委员会(CHMP)的积极推荐批准,用于与Alimta(培美曲塞)和铂类化疗药物(顺铂或卡铂)联合,一线治疗无EGFR或ALK基因组突变的转移性非鳞状非小细胞肺癌(NSCLC)成人患者,且不考虑PD-L1的表达水平。此外,CHMP也采取积极意见,建议批准Keytruda作为单药疗法用于治疗PD-L1阳性、肿瘤比例评分(TPS)≥50%且铂类化疗后无效的复发或转移性头颈部鳞状细胞癌(HNSCC)的成人患者。
5. 第一三共白血病新药获FDA突破性疗法认定。第一三共(Daiichi Sankyo)公司宣布其口服特异性FLT3抑制剂新药quizartinib已获FDA授予突破性疗法认定,用于治疗罹患复发性/难治性FLT3-ITD急性骨髓性白血病(AML)的成年患者。Ⅲ期临床试验结果显示,与化疗相比,quizartinib单一疗法延长了复发性/难治性FLT3-ITD急性骨髓性白血病患者的总生存期(OS),且安全性与quizartinib的临床开发项目一致。
6. 大冢制药AML药物 III期研究未达主要终点。日本大冢(Otsuka)制药宣布,guadecitabine (SGI-110)在治疗先前未治疗的成人急性髓性白血病(AML)(这些成人患者不适合进行强化诱导化疗)的III期临床研究(ASTRAL-1研究)中未达到主要终点。结果表明,与对照组相比,guadecitabine没有显著延长总体存活(OS)或改善完全应答率(ORR)。Guadecitabine是一款DNA甲基转移酶抑制剂,药物临床试验ASTRAL-2/3将继续开展。
7. Ultragenyx以8060万美元卖出一张PRV。协和发酵麒麟(Kyowa Hakko Kirin)透露与Ultragenyx公司将以8060万美元的价格出售他们因罕见儿科病药物Crysvita(burosumab)而获得的优先审评券(PRV),具体受让方未披露。去年12月,Ultragenyx曾以1.3亿美元的价格将其因酶替代疗法Mepsevii获得的PRV向诺华(Novartis)出售。而此次交易价格也创下PRV市场交易价的新低,原因是市场上PRV的存量因FDA的政策推动而稳步增加。
8. Liquidia完成5000万美元的IPO。Liquidia Technologies公司宣布完成数额为5000万美元的首次公开募股(IPO)。该公司是一家利用名为PRINT的创新技术平台,革新药物配方生产过程的后期临床阶段生物医药公司。此轮融资将用于推动该公司的两项候选药物,LIQ861和LIQ865的临床试验。其中LIQ861是一种治疗肺动脉高压(pulmonary arterial hypertension, PAH)的干粉吸入配方,而LIQ865是用于控制手术后疼痛的布比卡因(bupivacaine)持续释放配方。
医药热点
1. 我国肾脏移植术后3年肾存活率已超92%。国家卫生健康委员会医政医管局有关负责人郭燕红日前在广州召开的专题新闻发布会上表示,我国肾脏移植术后1年、3年肾存活率分别为97.9%、92.65%,达到国际较先进水平。以器官移植为代表的器官功能替代治疗取得较好成效。
2. 国家医保局:通过带量采购推动药品价格下降。近日,国家医疗保障局局长胡静林赴上海开展工作调研时强调,要精心组织好药品集中采购试点工作,通过带量采购推动药品价格下降;要加强顶层设计,规范各类标准,尽早实现全国医保信息系统互联互通;坚决打击骗保行为。
3. 宫颈癌筛查利器careHPV获世卫组织资格认证。中国肿瘤医院研究团队宣布,其联合凯杰生物、PATH、世卫组织国际癌症研究署等研发的careHPV完成临床验证,并获世卫组织资格认证,可在全球推广使用。相关数据显示,careHPV检测女性是否患有癌症前期宫颈疾病的能力优于常规方法,敏感度为90%,特异度为84.2%,且性能接近发达国家和地区目前普遍使用的HPV DNA杂交捕获检测技术(HC2)。同时,针对发展中国家和地区的政府采购,该款检测试剂的定价约为5美元。
4. 阿司匹林或可预防卵巢癌。《柳叶刀肿瘤学》刊登了《阿司匹林对卵巢癌的治疗有作用吗?》与《一项定群研究(NHS/NHSII):关于确诊前后使用常见镇痛药与卵巢癌预后》。前一项研究通过调查全球75万女性,综合13项研究数据得出,每日服用低剂量(约81毫克)阿司匹林的女性比未服用者患卵巢癌的风险低10%。后一项研究分析近1000名已被诊断患有卵巢癌女性的数据,发现使用阿司匹林或其他非甾体抗炎药的患者比未使用的生存率高30%。
5. 诱导多能干细胞治疗帕金森病的临床试验获准开展。日本政府日前批准日本京都大学利用诱导多能干细胞(iPS细胞)治疗帕金森病的临床试验计划,这将是iPS细胞首次被用于治疗人类帕金森病。该试验将招募数名药物治疗效果不佳的帕金森病患者,并将于近期公布具体计划。诱导多能干细胞是通过对成熟体细胞“重新编程”培育出的干细胞,拥有与胚胎干细胞相似的分化潜力。
股市资讯
上个交易日 A 股医药板块 -0.43%
涨幅前三 跌幅前三
奇正藏药 +9.97% 海南海药 -6.23%
江中药业 +5.38% 振东制药 -6.07%
智飞生物 +5.27% 沃华医药 -5.82%
【科伦药业】近日获得国家药品监督管理局核准签发的化学药品“中长链脂肪乳/氨基酸(16)/葡萄糖(16%)电解质注射液”的《药品注册批件》。
【信立泰】公司收到国家药品监督管理局核准签发的替格瑞洛片《药品注册批件》,已按照一致性评价的要求完成生物等效性实验,为国内首家仿制并获批上市。
【恒瑞医药】近日收到国家药品监督管理局核准签发的关于盐酸氨溴索片的《药品补充申请批件》,该药品通过仿制药质量和疗效一致性评价。
【亚宝药业】收到国家药品监督管理局核准签发的《药物临床试验批件》:SY-009 胶囊,为公司与美国礼来合作开发的用于治疗Ⅱ型糖尿病的新型口服药物。
【丽珠集团】全资子公司丽珠集团利民制药厂近日收到广东省食品药品监督管理局颁发的《药品GMP证书》。
【华北制药】公司收到河北省食品药品监督管理局颁发的《药品 GMP 证书》。
【健康元】控股子公司丽珠集团全资子公司丽珠集团利民制药厂近日收到广东省食品药品监督管理局颁发的《药品GMP证书》。
【阳普医疗】控股子公司南京阳普藤医疗科技有限公司完成《医疗器械经营许可证》变更登记,并取得《医疗器械经营许可证》:本次经营范围增加了6840 诊断试剂,同时变更经营场所和库房地址。
【博济医药】本次回购注销限制性股票 35.35万股,占回购前公司总股本的 0.2633%;回购和注销登记手续已完成;总股本由1.343亿股变为1.339亿股。
审评动向
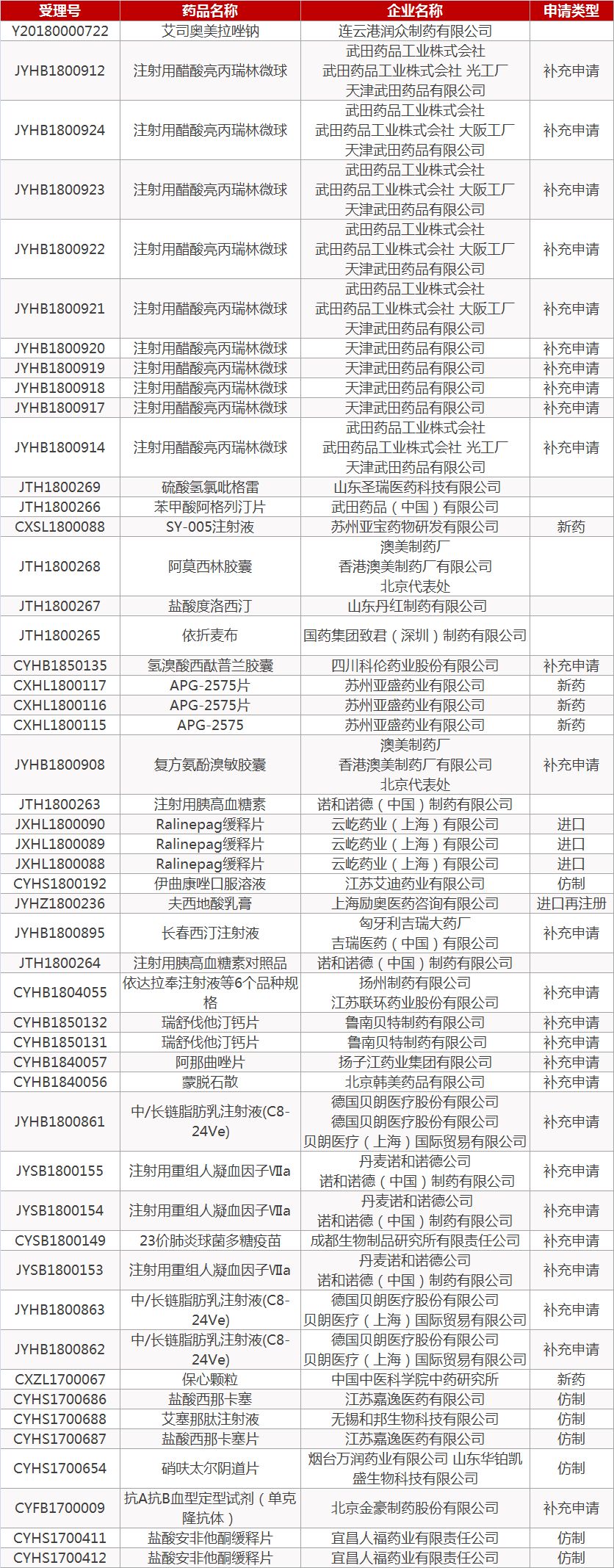
1. CDE最新受理情况(8月2日)
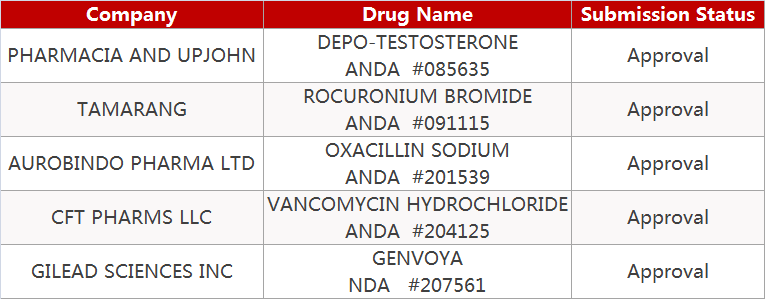
2. FDA最新获批情况(北美8月1日)
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发