小细胞肺癌免疫治疗的研究进展
| 导读 | 免疫治疗是依靠肿瘤患者自身免疫系统清除肿瘤细胞。此研究机制给SCLC患者带来了希望,本文将对SCLC免疫治疗机制、最新临床试验结果及免疫治疗的不足之处加以综述。
|
小细胞肺癌(SCLC)是肺癌中侵袭性强,生长速度快,早期易远处转移的神经内分泌肿瘤,约占肺癌患者10%~15%。虽然一线化疗对80%SCLC患者有效,但终将出现疾病进展,二线治疗后暂无指南推荐的标准治疗药物。免疫治疗是依靠肿瘤患者自身免疫系统清除肿瘤细胞。此研究机制给SCLC患者带来了希望,本文将对SCLC免疫治疗机制、最新临床试验结果及免疫治疗的不足之处加以综述。
SCLC免疫治疗的机制
有研究表明,机体免疫系统可以识别和清除肿瘤细胞,此为肿瘤免疫治疗的理论基础。肿瘤抗原蛋白借助树突细胞的摄取和呈递,激活T细胞,从而杀伤肿瘤细胞。肿瘤细胞还可以利用保护正常组织免受炎症反应伤害的免疫检测通路(如PD-1通路)逃避免疫系统攻击。因此抵抗免疫逃逸系统的思维方式可能会开启肿瘤免疫治疗的新篇章。
SCLC存在免疫原性,临床患者常伴发与原发肿瘤或转移病灶无直接关系的症状或体征,例如Lambert-Eaton综合征,发生机制主要是表达于SCLC肿瘤细胞表面和正常神经细胞表面的相同抗原产生的特异性免疫反应所致。
SCLC存在免疫原性的另一证据是免疫活性与患者预后存在相关性。例如,肿瘤细胞浸润CD45+T细胞数目越多,SCLC患者的生存期越长。最新数据显示,肺癌突变负荷越大,对抑制PD-1通路的免疫治疗药物敏感性越高。而SCLC具有高突变负荷的特征,因此PD-1通路抑制剂可能成为SCLC的有效治疗方法。
免疫治疗
免疫治疗是指借助肿瘤细胞免疫原性激发宿主对肿瘤抗原产生免疫应答,以杀伤肿瘤细胞。由于免疫治疗一旦起效疗效持久,且不良反应相对少等特点,倍受临床关注。现阶段CTLA-4与PD-1/PD-L1是研究较为火热的2个免疫靶点。
2.1抗CTLA-4免疫治疗
CTLA-4是一种表达于T细胞表面的跨膜蛋白受体,在T细胞激活的早期发挥免疫调节作用。代表性药物为依匹单抗。已证实依匹单抗可明显延长中晚期黑色素瘤患者的总生存,且对于依匹单抗的研究正逐渐向SCLC免疫治疗领域发展。基于某种化疗药物能够增加依匹单抗活性的临床前研究结果,一项Ⅱ期临床试验,在紫杉醇+卡铂基础上加用依匹单抗治疗晚期肺癌患者疗效及安全性的结果显示,针对SCLC亚组,其结果是单用化疗、化疗与依匹单抗分时段及同步3组免疫相关的无进展生存期(irPFS)分别是5.3个月、6.4个月和5.7个月;中位生存时间(mOS)分别是9.9个月、12.9个月、9.1个月;中位无进展生存期(mPFS)分别是5.2个月、5.2个月、3.9个月。3组的irPFS、mPFS、mOS均无统计学差异。因此,化疗的基础上加用依匹单抗并未延长患者的无进展生存期(PFS)及总生存期(OS)。此研究的局限性在于紫杉类+卡铂方案并不是SCLC患者传统的标准治疗方案,因此在此方案基础上加用依匹单抗临床实用价值有限。同时3组治疗期间不良事件的发生率,加用依匹单抗组均高于单用化疗组。较为突出的不良事件包括腹泻、口腔炎、肺炎、寒颤、皮肤瘙痒、皮疹等。结论是化疗基础上加用依匹单抗不但未改善总生存,还增加了不良反应。
2017年5月结束的一项随机Ⅲ期临床试验结果显示,依匹单抗+化疗组(依托铂苷/铂类)与化疗+安慰剂(对照组)mOS分别为11个月和10.9个月;mPFS分别为4.6个月和4.4个月。依匹单抗+化疗联合组与对照组发生严重不良事件的比例分别为316/562(56.23%)和278/562(49.55%)。其中粒缺性发热、垂体炎、甲亢、甲减、恶心呕吐、腹泻、结肠炎的发生率明显高于对照组;另外发生药物所致肝损伤、肺炎、败血症、急性肾衰竭、肺栓塞、皮疹的例数依匹单抗联合治疗组亦较高。治疗相关的停药的比率,2组分别为18%和2%。且联合治疗组中有5例发生治疗相关的死亡,2例死于结肠炎,2例死于败血症,1例死于肝毒性;对照组治疗相关的死亡有2例,1例死于败血症,1例死于重度骨髓抑制。结论是对于新诊断的广泛期SCLC患者在依托铂苷联合铂类化疗的基础上加用依匹单抗未能延长患者的总生存,却增加了免疫药物相关不良反应及死亡风险。
依匹单抗联合其他治疗方法,包括依托铂苷/卡铂、放疗、纳武单抗等的临床研究都在进行中(表1)。一项依匹单抗联合依托铂苷+卡铂治疗广泛期SCLC的Ⅱ期临床研究,暂入组42例患者,38例可进行有效性评估,6/38例通过RECIST评估标准达到1年的无进展生存时间。mPFS、irPFS、mOS分别为6.7个月、7.3个月、17个月。根据RECIST评估标准和免疫相关评估标准,21/29例(72.4%)存在客观疗效,28/33例(84.8%)存在免疫相关的客观反应。35/39(89.7%)例存在至少一种以上的3级不良反应,27例(69.2%)与依匹单抗相关。出现神经系统不良事件的患者有19例(49%),其中有4例(10%)患者程度为5级,并有3例(8%)与应用依匹单抗有关,1例患者伴有严重头痛症状,已证实此患者头痛症状与预防性颅脑照射无关,因此推测引起头痛的原因很可能与依匹单抗所致的中枢神经损伤有关。其他发生率较高的与免疫治疗相关的不良事件包括腹泻(72%)和皮疹(51%)。共发生5例(13%)与依匹单抗药物相关的死亡事件,2例患者是由于治疗期间出现的心脏原因和粒细胞减少性脓毒症,另外3例是在治疗结束4~5个月分别出现了肺炎,自身免疫性脑炎及脓毒症。结论是患者的mOS(17个月)高于近期其他临床试验数据报道结果(14个月),但此研究入组患者数量较少,还需Ⅲ期临床试验予以研究证实。对于某亚组的晚期SCLC患者可能会获益于依匹单抗联合依托铂苷/卡铂治疗方案,因此需要寻找新型的Biomarker挑选更适合免疫治疗的优势人群。
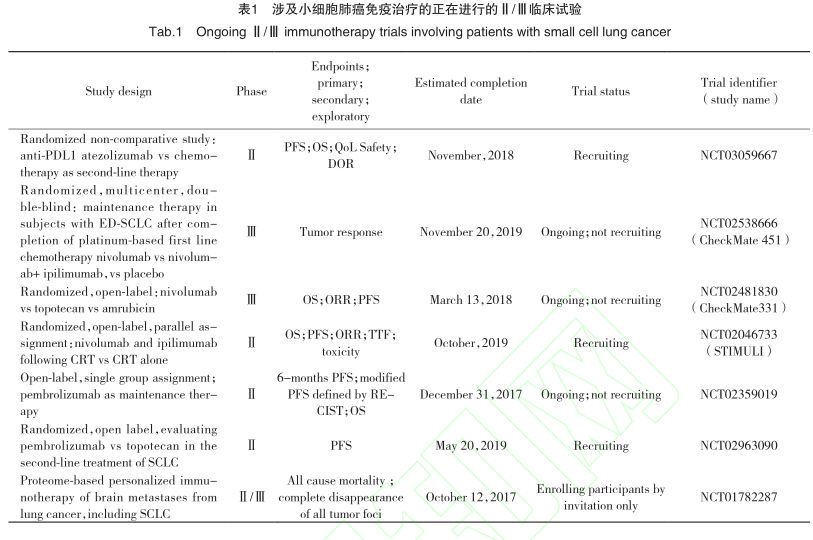
2.2抗PD-1/PD-L1治疗
表达于T细胞表面的共抑制受体PD-1与PD-L1,在肿瘤细胞侵袭宿主免疫系统中起到重要作用。临床前研究显示,PD-1/PD-L1高表达的肿瘤细胞可产生免疫逃逸,进而实现肿瘤局部浸润及远处转移,并与肿瘤患者病情的控制和治疗结果有关。
一些抗PD-1/PD-L1治疗SCLC患者的研究已获得了较好效果。有关PD-1抑制剂纳武单抗的临床试验CheckMate 032显示超过一半的患者既往接受过2种或2种以上化疗方案,但1年的总生存率(纳武单抗3 mg/kg单药组和纳武单抗1 mg/kg+依匹单抗3 mg/kg组)与以往二线治疗(拓扑替康或氨柔比星)数据相比基本一致。大部分的治疗相关不良反应为轻度到中度,低于临床试验报道的拓扑替康或氨柔比星治疗所致不良反应发生率。其中纳武单抗3 mg/kg单药组、纳武单抗1 mg/kg+依匹单抗3mg/kg组、纳武单抗3 mg/kg+依匹单抗1 mg/kg组、纳武单抗1mg/kg+依匹单抗1 mg/kg组发生3/4级不良事件的例数分别是13/98(13%)、18/61(30%)、10/54(19%)、0/3(0%)。在纳武单抗1 mg/kg+依匹单抗mg/kg组有2例患者死于治疗相关不良反应(包括重症肌无力和肾功能衰竭);而纳武单抗3 mg/kg+依匹单抗1 mg/kg组有1例患者死于治疗相关肺炎。此研究中SCLC患者不良反应的发生率似乎高于其他恶性肿瘤,可能与SCLC患者存在副瘤综合症相关。既往研究结果显示,出现免疫相关不良反应越明显,预示着可能会有较好的治疗效果。因此SCLC患者是否存在某一优势人群,会产生免疫治疗最佳疗效。此研究纳入的患者并没有考虑到一线方案的疗效,若对不同疗效亚组进行分析,可能会有新的发现。且此研究患者的疗效是相比于二线化疗方案(拓扑替康或氨柔比星),而临床中常用的二线治疗以环磷酰胺+表柔比星+长春新碱三药联合方案较多,且临床中随着用药规范及辅助用药的保驾护航,化疗相关的死亡风险亦已降低至接近为零。因此抗PD-1/PD-L1治疗SCLC还需要更多Ⅲ期试验支持。
一项头对头比较纳武单抗和化疗(拓扑替康或氨柔比星)的随机、开放、Ⅲ期临床研究(Check-Mate331),共招幕局部或晚期一线接受以铂类为基础化疗方案进展的SCLC患者568名,研究数据将于2018年3月初步完成统计,此研究结果对于SCLC未来选择二线治疗方案将会有一定的影响。而一项随机、开放、Ⅱ期临床研究(STIMUL)比较传统放化疗治疗后序贯纳武单抗+依匹单抗与单用放化疗治疗局限期SCLC患者有效性及毒性反应的差异,计划于2019年10月结束数据采集。此研究结果可能对于SCLC提高5年生存率带来新希望。目前广泛期SCLC患者在一线含铂双药联合化疗结束后,稳定期除了选择中药作为维持性治疗外,目前尚无标准治疗方案可供选择。一项随机多中心、双盲的Ⅲ期临床试验正在对晚期SCLC一线以铂类药物为基础治疗后的患者进行研究,比较应用纳武单抗,纳武单抗+依匹单抗以及安慰剂作为维持性治疗时3组的OS与PFS差异。进而解决SCLC维持性治疗方案选择问题。针对PD-1靶点的另一个免疫抑制剂帕姆单抗的临床试验CheckMate 028旨在研究对于一线治疗失败的PD-L1阳性的广泛期SCLC患者帕姆单抗的有效性和安全性,疗效结果显示与既往拓扑替康的反应率(7%~24%)相比,帕姆单抗是33.3%,且疗效的维持时间更长。药物不良反应与其他实体肿瘤相似。此研究结果预示着对于多线治疗失败的SCLC患者,帕姆单抗可能会改变PD-L1阳性的亚组患者的治疗现状。而正在进行的针对复发耐药SCLC的另一项随机、开放的Ⅱ期研究,其意义在于研究帕姆单抗可否延长拓扑替康作为标准二线方案治疗的PFS,若结果为肯定,则SCLC患者增加了二线治疗药物的选择。
PD-L1除了作为PD-1配体实现肿瘤免疫逃逸,还可作为受体与T细胞表面的CD80分子结合,传递免疫抑制信号。因此阻断PD-L1可以移除免疫抑制信号,并刺激机体抗肿瘤系统。
讨论
肺癌的治疗已从化疗时代、靶向治疗时代,逐渐迈向Check-point抑制剂时代。大量临床试验正在探索免疫抑制剂在SCLC患者治疗过程中的临床价值,由于SCLC二线后暂无标准治疗方案可以选择,因此免疫治疗可能成为目前临床具有前景和挑战性的新方法,现已有临床试验证实免疫治疗疗效不劣于非标准的化疗方案,但在标准化疗方案的基础上加用免疫治疗尚无确切数据证实有临床获益,与此同时却增加了临床不良事件发生率及治疗相关死亡风险。且试验入组患者例数较少的情况下,已出现较多患者死亡,因此引发对免疫治疗方法的深思。首先分析SCLC免疫治疗疗效低于其他恶性肿瘤,一方面可能由于SCLC本身恶性程度高,肿瘤异质性强等特点,肿瘤细胞内存在尚未被发现的其他特殊的免疫治疗重要靶点;另一方面,SCLC倍增时间短,进展迅速,而免疫治疗起效时间相对较长,免疫治疗尚未达到最大获益时,SCLC可能已发生病情进展及远处转移。最新的研究数据得出纳武单抗单药或联合依匹单抗治疗肿瘤突变负荷(TMB)高的SCLC客观反应率和总生存优于TMB平均值或低值的SCLC人群。分析其原因可能是由于SCLC患者TMB高,而TMB高会产生较多的新抗体,更适合接受免疫治疗。因此需要找到更优的Biomarker,如PD-L1、TMB等指导临床治疗,并期待SCLC治疗领域不久将翻开新的篇章。(转化医学网360zhyx.com)

-
 游客2018-07-31 13:56:00可否附原文链接在后面呀,否则想从原文中找信息或者引用的时候多有不便
游客2018-07-31 13:56:00可否附原文链接在后面呀,否则想从原文中找信息或者引用的时候多有不便
 正在加载
正在加载 腾讯登录
腾讯登录