巨噬细胞的重编程 - 一种巧妙的癌症免疫治疗方法
| 导读 | 芬兰图尔库大学的MaijaHollmén博士试图通过针对先天免疫细胞的肿瘤支持功能来产生免疫攻击的肿瘤,从而增强癌症免疫疗法。 |
芬兰图尔库大学的MaijaHollmén博士试图通过针对先天免疫细胞的肿瘤支持功能来产生免疫攻击的肿瘤,从而增强癌症免疫疗法。
人们普遍认为癌症与炎症有关,这可能在改善癌症免疫治疗方面发挥关键作用。例如,已知慢性炎性疾病会增加癌症的发病率,并且非甾体抗炎药的使用降低了患癌症的风险以及降低由某些癌症引起的死亡率。另一方面,没有潜在炎症的肿瘤,遗传事件如癌基因突变和染色体重排增加了炎症介质的产生,这些介质为癌症的发展建立了炎症性肿瘤微环境。
无论最初的肿瘤促进事件如何,癌症相关炎症的共同特征是单核吞噬细胞系的细胞的存在,其分化成对恶性进展具有不同作用的巨噬细胞的特化亚群。
癌症的进展取决于抗肿瘤免疫应答的质量和数量。在癌症免疫监视期间,淋巴细胞不断地通过血液,淋巴组织和淋巴管系统巡逻。促炎和细胞毒性免疫应答在限制肿瘤进展中是必需的,而抗炎免疫细胞类型通常矛盾地促进肿瘤生长。例如,调节性T细胞(Treg)和活化的巨噬细胞可引起免疫抑制,这是成功治疗癌症的主要障碍之一。控制肿瘤内抑制细胞存在的可能性是开辟抗癌增长新途径的关键因素。
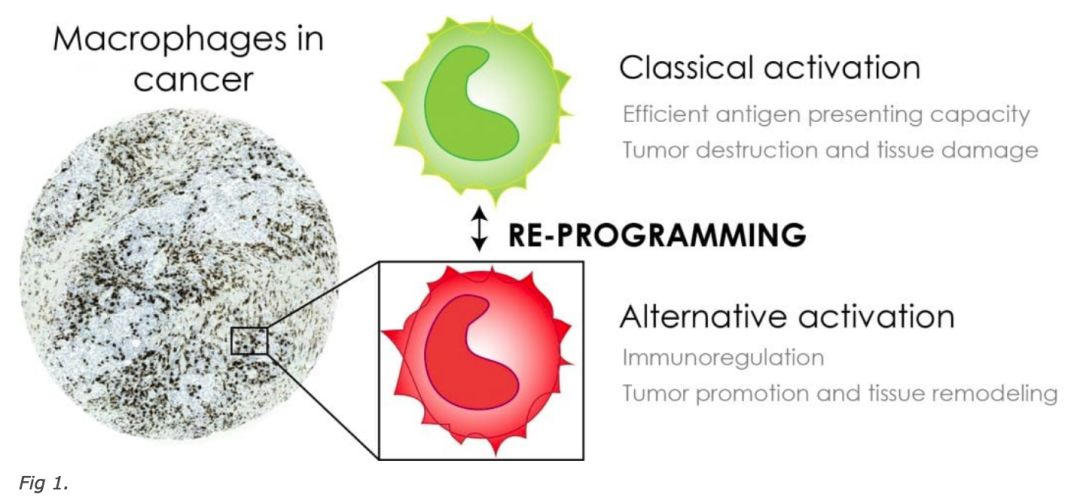
巨噬细胞形成了对入侵病原体的第一道防线,它们在维持组织稳态方面起着至关重要的作用。巨噬细胞被称为免疫系统的瑞士军刀,因为它们在免疫激活和解决炎症方面具有大量功能。巨噬细胞可以通过诱导T细胞募集和激活来促进针对肿瘤细胞的免疫。然而,它们在肿瘤微环境中的存在与几种肿瘤类型的不良预后相关。事实上,已显示肿瘤相关巨噬细胞(TAM)促进癌细胞生长和传播以及血管生成和免疫抑制。此外,已显示TAM改变对激素和化学治疗剂的反应。
这种争议源于单核吞噬细胞的功能可塑性,其表达响应不同微环境信号的促肿瘤或抗肿瘤功能。在最初的致癌过程中,肿瘤浸润的髓单核细胞代表经典活化的巨噬细胞,其对癌细胞具有细胞毒活性。它们具有高抗原呈递能力和高白细胞介素(IL-12和IL-23)产生,并且它们释放高水平的活性氧中间体和肿瘤坏死因子-α(TNFα)。随着肿瘤的发展,TAMs响应于高水平的集落刺激因子-1(CSF-1)和免疫抑制细胞因子如恶性转化细胞或其他基质区室表达的IL-4和IL-10而被激活。
肿瘤相关巨噬细胞是靶向癌症免疫疗法的高度合格候选者,因为这些细胞大量存在于各种肿瘤中,它们非常可塑并且可以转化为支持T细胞活化和肿瘤排斥的促炎巨噬细胞。
目前针对巨噬细胞的方法包括:
消除巨噬细胞;
刺激巨噬细胞;
抑制巨噬细胞运输到组织;
巨噬细胞的重编程。
迄今为止,临床开发中的大多数靶向巨噬细胞的策略利用巨噬细胞集落刺激因子受体抑制来消耗或重编程肿瘤中的巨噬细胞群。尽管在一些临床前研究中取得了有希望的结果,但CSF-1R阻断作为单一疗法的临床疗效相当令人失望。
值得注意的是,巨噬细胞消耗策略具有依赖于背景的缺点,因为它们还可促进促炎性巨噬细胞的消耗,其介导有利的抗肿瘤免疫应答。事实上,已经证明抗CSF-1R治疗促进三阴性乳腺癌模型中淋巴结包膜下窦巨噬细胞的消耗.
除此之外,一些研究报道了在各种肿瘤模型中对CSF-1R抑制的抗性,因为存在影响巨噬细胞存活和分化的其他因素。因此,迫切需要找到更好的方法来利用这些细胞作为对抗癌症的盔甲。
巨噬细胞的重编程 - 一种巧妙的癌症免疫治疗方法
激活和抑制免疫反应都需要维持身体的适当稳态。有趣的是,在怀孕期间,胎盘中存在免疫抑制性环境以容忍胎儿的生长。同样,发展中的肿瘤利用免疫系统自身发展。两种情况的共同特征是Clever-1阳性巨噬细胞的高丰度,其支持免疫抑制组织微环境的形成。
什么是Clever-1?
Clever-1,也称为Stabilin-1和Feel-1,是一种多功能分子,赋予活化巨噬细胞清除能力。在这些细胞中,它参与受体介导的内吞作用和再循环,细胞内分选以及改变的和正常的自身成分的转胞吞作用。虽然其他白细胞类型(粒细胞和淋巴细胞)是Clever-1阴性,但它也在组成型表达:
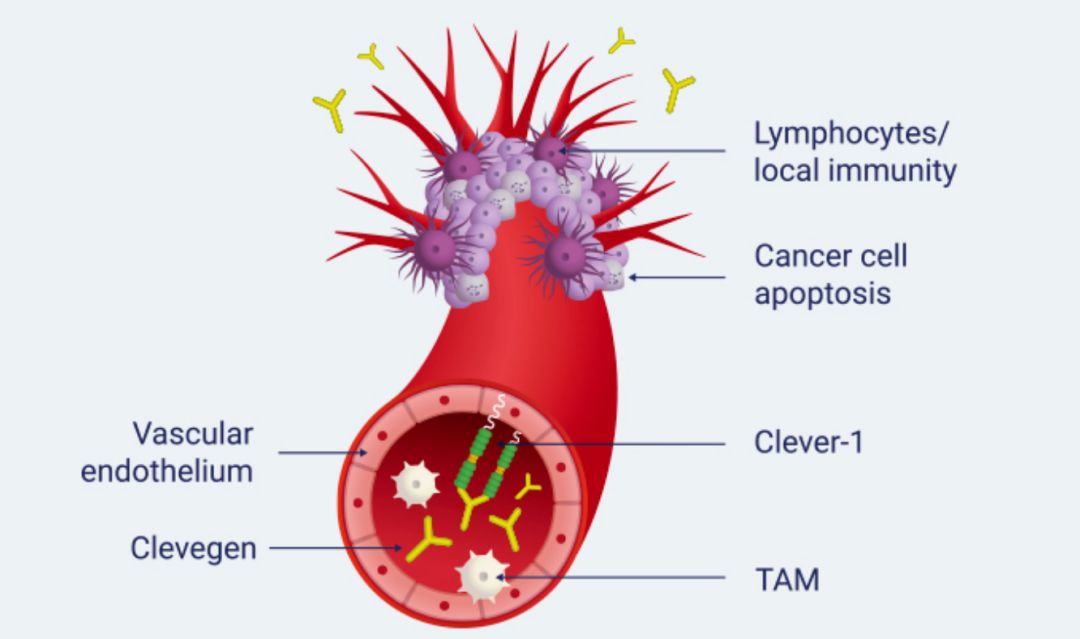
传入和传出淋巴管内皮细胞;
肝脏和脾脏中的正弦内皮细胞;
高内皮微静脉。
此外,在炎症时,它可以在血管内皮上被诱导,在那里它介导淋巴细胞,粒细胞和单核细胞从血液到发炎组织的运输。
目前的工作假设表明,Clever-1是抗炎巨噬细胞上的免疫转换分子,通过靶向抗体调节其功能,可以重新编程巨噬细胞作为促进抗肿瘤免疫的另一种策略。这是非常重要的,因为仅通过阻断T细胞抑制分子来重新激活针对肿瘤的免疫应答的努力未显示出作为绝大多数患者的单一疗法的希望。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发