NEJM:FDA批准前列腺癌药有新动态,延缓转移更重要
| 导读 | 2018年6月28日出版的《新英格兰医学杂志》(NEJM)上,美国食品药品管理局(FDA)药物评价及研究中心的Beaver等发表了一篇... |
2018年6月28日出版的《新英格兰医学杂志》(NEJM)上,美国食品药品管理局(FDA)药物评价及研究中心的Beaver等发表了一篇文章,介绍了FDA对于前列腺癌临床研究终点设计的特殊考量[1]。
今年较早时候,FDA批准了一种雄激素受体抑制剂阿帕鲁胺(apalutamide)用于治疗非转移性去势抵抗性前列腺癌(CRPC)患者。此次批准的基础是SPARTAN研究,这是一项随机安慰剂对照研究,共纳入1207例患者,结果显示治疗显著改善了无转移生存(定义为从随机化开始至影像学检出远处转移病变或死亡)[2]。这是首个获批准用于非转移性CRPC的药物,也是首次采用无转移生存作为首要终点来支持药物批准。
什么是非转移性CRPC?其定义为尽管睾酮已达去势水平,在无远处转移病变影像学证据的情况下,前列腺特异性抗原(PSA)升高的疾病状态。在美国普遍进行PSA筛查,大多数前列腺癌患者在无症状局部病变阶段就得到最初诊断。在检出PSA升高到出现转移或死亡,可以有多年的时间跨度。生存期如此之长,再加上现有的多种后续治疗方法可能会给结果带来混杂因素,采用总生存作为终点就显得不实用了,也激发研究人员在研究设计中采用更早的疗效终点。
FDA觉察到对于治疗非转移性CRPC的兴趣日益增长,为此在2011年召开了一次肿瘤药物咨询委员会会议,专门讨论可用于支持药物批准的临床研究终点以及研究设计。委员会成员们意识到,从非转移性CRPC过渡到可检出的转移性病变是一件具有临床重要意义的事件,可能与疼痛、疾病状态等相关,并且会带来进一步治疗的需求。他们的建议是,尽管无转移生存是一个合理的终点,但若要以此确保一种药物有临床获益,则需要有显著的改善幅度以及有利的获益风险评价结果。
2012年后,多家制药企业设计了采用无转移生存作为首要终点、总生存作为共同首要终点或次要终点的临床试验,以观察对非转移性CRPC的系统疗效。除了上述的SPARTAN研究,还有PROSPER研究评价了雄激素受体抑制剂恩扎鲁胺(enzalutamide)在非转移性CRPC治疗中的应用情况,后者结果也发表在6月28日出版的NEJM上 [3]。
SPARTAN研究结果很好地回应了FDA委员会对于研究终点的要求。研究结果显示,阿帕鲁胺治疗使估计中位无转移生存期由16.2个月显著延长到40.5个月。而且,至转移时间和无进展生存期(定义为随机化至局部、远处转移或死亡时间)也得到延长。当时总生存结果还未达到,但阿帕鲁胺治疗对此并无不利影响。该药耐受良好,尽管治疗时间长于安慰剂,两者严重不良反应发生率相近。FDA据此得出结论,该药对非转移性CRPC安全有效,并予以批准。
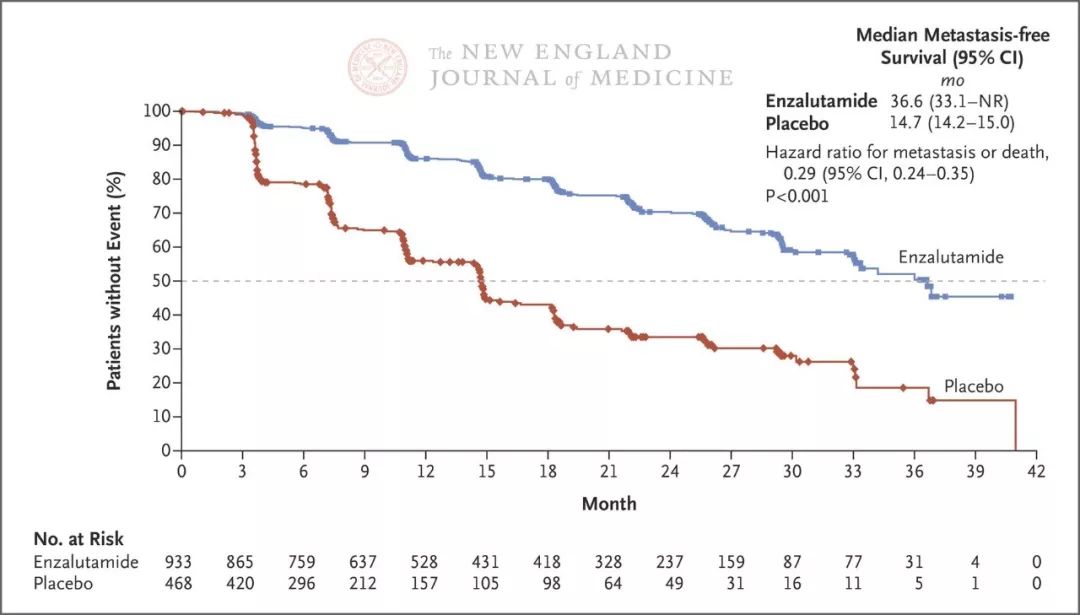
PROSPER研究是类似于SPARTAN的3期临床研究,结果也相近。该研究中,与安慰剂加雄激素剥夺治疗相比,恩扎鲁胺加雄激素剥夺治疗使转移或死亡风险降低了71%,转移出现时间延缓了22个月(见下图)。在今年3月,FDA对恩扎鲁胺治疗非转移性CRPC的补充新药申请给予了优先审批。另一项3期临床试验ARAMIS也采用了类似设计,旨在评价雄激素受体抑制剂darolutamide对无转移生存的影响,目前正在进行中(ClinicalTrials.gov号,
NCT02200614)。
但是,在非转移性CRPC临床研究中采用无转移生存也会带来一些挑战。终点的评估通过医学影像学检查进行,若检查敏感性增加,将会使检出转移病变的敏感性和特异性升高,很可能会影响研究结果的解读,甚至会使参与者的基线特征随时间发生改变。此外,按照无转移生存的定义,转移事件中不包括局部进展。由于并非所有研究都将局部进展排除,所以必须谨慎考察这种进展对总体结果的影响。目前,人们正在努力使非转移性CRPC的研究设计要素如纳入标准、终点定义等标准化,FDA也会在这方面继续和药物研发团体协作。
FDA对阿帕鲁胺的批准具有深远的影响。将来,对非转移性CRPC开展安慰剂对照临床试验的难度会大增,而一个活性药物对照和叠加研究设计的时代将开启。以阿帕鲁胺为对照的头对头比较研究很可能显示某药的获益幅度较小,但有明显证据表明该药带来的无转移生存结果更佳,在安全性类似于阿帕鲁胺的前提下,依然可以满足委员会的批准要求。而对于毒性较强的药物,则需要显示其大幅改善无转移生存。对于叠加研究设计,一种新药与阿帕鲁胺联合应用时,获益幅度需要胜过增加的药物毒性。
以往批准转移性前列腺癌的治疗方法都是基于生存获益。将来采用总生存作为首要终点会越来越难,由于有多种药物可以序贯用于晚期病变,使得研究必须规模更大、耗时更长,有可能会使结果解读变得混乱。另外,共存条件会影响生存,非癌症相关死亡的存在使单独分析药物疗效成为难题。
对于转移性病变已常规采用影像学无进展生存作为终点,但目前在非转移性CRPC研究中尚无更早的终点。现在FDA已经认识到,使病变转移出现得更晚也是一种客观指标,具有重要的临床相关性。将来若基于无转移生存批准药物,只能是由于该药物显示出对病变过渡到转移有重大影响,并且长期用药的安全性在可接受范围之内。
在我国,国家食品药品监督管理总局根据其2017年发布的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》制定的《临床急需药品有条件批准上市的技术指南》提出,对于临床急需药品,应用替代终点指标或中间临床终点指标的临床研究结果可以预测该产品很可能具有疗效和临床获益的,应有条件批准上市。我们应该可以期待,在不久的将来,阿帕鲁胺等药品也可以服务于中国的非转移性CRPC患者。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发