一文概览丨肿瘤免疫治疗的特征
| 导读 | 如今,免疫治疗可谓是肿瘤界的宠儿,尤其是免疫检查点抑制剂(ICIs)可能是最有前景的免疫治疗。ICIs与化疗、靶向治疗作用于肿瘤细胞不同,它是直接作用于自身免疫系统,阻断免疫检查点(如PD-1)与其配体结合,恢复T细胞的活化和增殖,以达到杀伤肿瘤细胞的作用。 |
不同于传统治疗的作用机制也让免疫治疗产生了独有的特征。体现在疗效上有应答持久、长期生存;在应答模式上有非常规的延迟反应及假性进展;而又因为它非常规的应答模式,可能需要新的评估终点;最后在毒副作用上,也有其独特的免疫治疗相关不良反应(irAE)。
应答持久,长期生存
抗肿瘤免疫应答是一个不断重复循环的过程,它可以随着时间的增长,不断地增强和扩大,而且T细胞会进一步记忆肿瘤抗原,转换为成熟的记忆T细胞,即使在肿瘤抗原刺激不存在的情况下,也能杀伤肿瘤细胞。持久的识别和免疫记忆使抗肿瘤免疫应答持续存在,从而带来长期生存获益[1-3]。
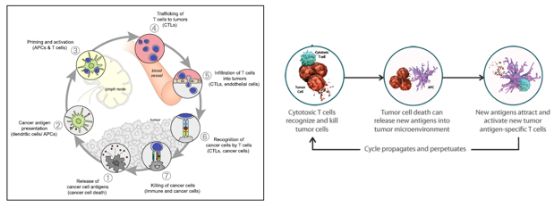
图1.抗肿瘤免疫应答不断循环持续
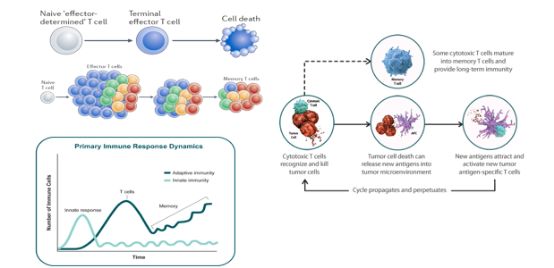
图2.免疫记忆
目前已经有很多临床研究进一步体现了ICIs应答持久和长期生存的特点,免疫治疗的临床试验的生存曲线都成“长尾巴”状,而且未出现进展的患者维持时间较长。
长期生存:目前肺癌免疫治疗随访时间最长的生存数据来自nivolumab的CA209-003研究,其5年随访结果显示,nivolumab单药治疗经治晚期NSCLC患者的5年生存率高达16%,相对于传统治疗提高了3倍。
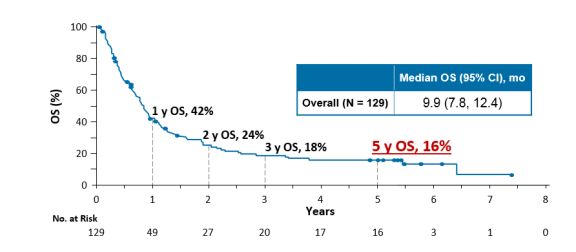
图3.CA209-003研究中的OS获益
另外,还有nivolumab全球Ⅲ期临床研究——CheckMate017/057的3年随访结果显示,鳞状、非鳞状的晚期NSCLC患者二线使用nivolumab的3年生存率分别可达到16%和18%。
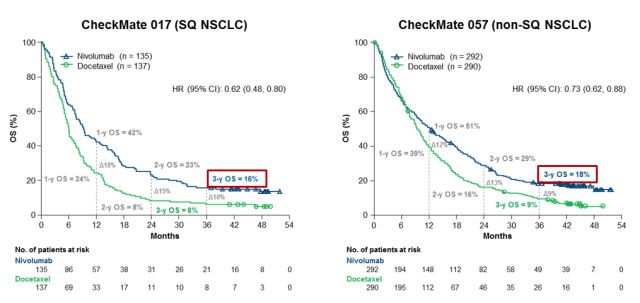
图4.CheckMate017和CheckMate057研究中的OS获益
在今年ASCO上公布的Keynote-001研究的4年随访结果显示,PD-1抑制剂pembrolizumab与多西他赛相比,可提高经治晚期NSCLC患者的4年生存率。而且该研究中还有101例患者接受了一线治疗,其一线、后线治疗的预估4年生存率分别为27.2%和16.4%,PD-L1表达阳性的NSCLC患者,无论初治还是后线,均可从pembrolizumab治疗中显示出OS获益[4]。
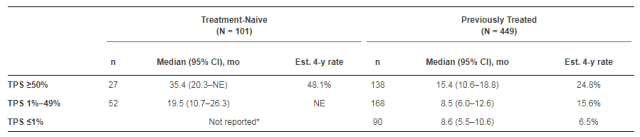
图5.Keynote-001研究中,不同PD-L1表达水平的OS获益
应答持久:CA209-003研究中有75%的患者在nivolumab治疗之后未接受任何治疗,在最后一次随访时仍未进展。CheckMate 017研究中,使用nivolumab的鳞状NSCLC患者的3年中位缓解时间(DoR)为25.2个月,且随访3年时,26%患者仍在持续缓解中。
CheckMate 057研究中,随着随访时间延长,使用nivolumab的非鳞状NSCLC患者的DoR延长(1年时DoR为 17.2个月,3年时DoR增长为18.3个月),且随访3年时仍有23%的患者产生持续的疗效。
CheckMate 003/Keynote-010研究均表明:PD-1抑制剂治疗2年后停药,大部分患者仍在持续应答。应用nivolumab联合ipilimumab治疗黑色素瘤的CheckMate 069研究表明,即使由于毒性反应等原因停药,治疗反应仍可持续一段时间。
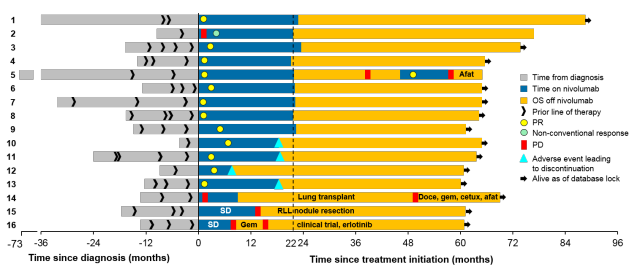
图6. CA209-003研究中,75%的5年存活患者仍在应答
非常规应答模式
传统疗法治疗癌症后会出现三种肿瘤体积或径线变化形式:肿瘤体积或单径不断缩小(有效);肿瘤长大(疾病进展);肿瘤体积或径线无变化(稳定)。而相比原来的三种可能性,在免疫治疗时可能会多增加两种应答模式:延迟反应和假性进展。
延迟反应:临床上将治疗12周后出现的治疗反应划归为延迟反应。化疗药物效应发挥迅速,在临床上给予1-2轮化疗药物后看到的临床疗效可以直接预测完成全部化疗方案后的治疗效果。而由于免疫治疗独特的作用机制,其在治疗后可能不会立即诱导可测量到的肿瘤缩小,可能需要数周到数月才起效。但总体来说,免疫治疗发生延迟反应的比例较低,比如CheckMate 017/057、Keynote-001研究显示,从整体来看,免疫治疗起效的时间与化疗基本相当,均值为2.2个月左右。
假性进展:免疫治疗后一部分患者放射学检查后可能会观察到肿瘤病灶大小初步增加或出现新的病灶,通过活检证实为坏死或炎性细胞浸润伴随肿瘤负荷的减少,随后继续治疗病灶缩小,这种非传统的临床反应被认为是假性进展[5]。
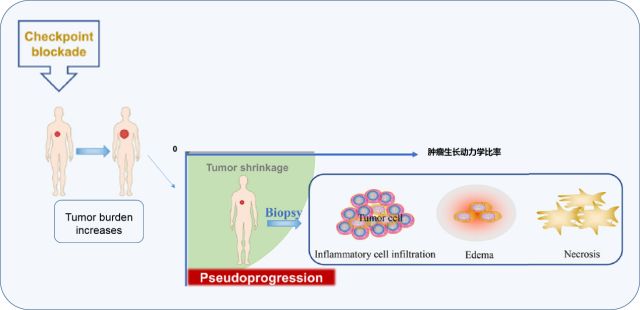
图7. 假性进展
同样地,假性进展在免疫治疗中并不算常见。一项对接受PD-1抑制剂的晚期NSCLC患者的3年回顾性研究发现,在228例患者中有50例(9%)发生假性进展[6]。OAK 研究中3.6%患者发生假性进展,在进展后继续接受atezolizumab治疗的患者中有7%靶病灶持续退缩(进展后缩小≥30%),49%的患者在继续使用atezolizumab后靶病灶稳定[7]。CheckMate066\067汇总分析显示,进展后继续接受nivolumab治疗的黑色素瘤患者有28%的患者靶病灶退缩>30%[8]。
我们可以从体力状况、系统症状、肿瘤增大症状、肿瘤大小(基线、新病灶、活检)等方面鉴别疾病进展(PD)和假性进展。比如影像学发现肿瘤病灶增大,但是患者的PS评分没有下降、症状也没有加重,那么他有可能是假性进展。除此而外,活检可以发现,PD的增大病灶是增殖的肿瘤细胞,假性进展则是T细胞的浸润[9-12]。
|
鉴别特征 |
疾病进展 |
假性进展 |
|
|
体力状况 |
恶化 |
稳定或改善 |
|
|
系统症状 |
恶化 |
可能改善 |
|
|
肿瘤增大的症状 |
出现 |
可能不会出现 |
|
|
肿瘤大小 |
基线 |
增大 |
增大 |
|
新病灶 |
出现,并且增大 |
出现,保持稳定或随后缩小 |
|
|
活检结果 |
肿瘤增大 |
T细胞浸润 |
|
表1.疾病进展和假性进展的区别
适宜的疗效评估标准
由于肿瘤免疫治疗的特征,按照传统的疗效评价体系(WHO标准和RECIST标准)来评价肿瘤免疫治疗的疗效,往往会由于没有明显的瘤体改变而得出治疗无效的结论。比如,使用RECIST标准判定为PD,而继续治疗以后肿瘤会进一步缩小5。因此,继续使用传统的WHO 标准和RECIST 标准已经不能适应肿瘤免疫治疗这一新兴的肿瘤治疗方法,肿瘤免疫治疗需要更合理的、更可行的疗效评价新标准。
目前,常用于评判肿瘤免疫治疗的标准有irRC标准和iRECIST标准,分别是从WHO和RECIST标准改良而来。在靶病灶进展及出现新病灶时,它们都需要再次确认才评估为PD。irRC标准需在至少4周内对影像学PD进行再次确认;iRECIST标准需在4-8周内对影像学PD进行再次确认。
但这两个评价标准仍存在局限性。比如irRC标准存在测量变异性, irRC标准是以二维测量来量化肿瘤负荷,出现25%的增长则定义为PD,但是二维测量具有变异性。另一个局限是由irRC或iRECIST标准确认PD所需的最小时间范围造成的。由于假性进展和后续应答的时间范围可能比目前假设的范围更广,假性进展可能会在确诊为irRC-PD或iRECIST-PD后出现反应5。
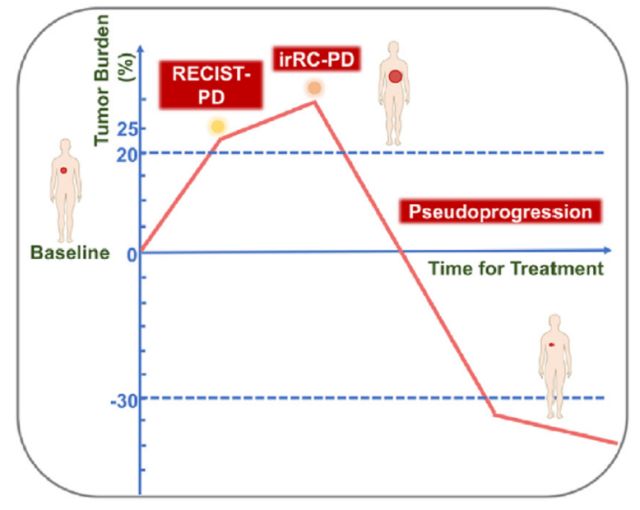
图8.即使irRC-PD和iRECIST-PD,假性进展也可能会有反应
在假性进展第一次出现时,仅靠放射学证据是很难将它和PD区分开,在ICIs治疗后对增大病灶进行病理活检可以有效帮助判断假性进展。然而,执行活检的最合适时间目前尚不清楚,此外,增大病灶活检可能不适用于某些患者。因此,临床医生可能还需要依靠其他信息来评估肿瘤反应。除了放射学证据和活检之外,临床评估在对ICIs治疗患者的医学决策时也起着关键作用[5]。
今年3月份发表在JAMA Oncology的一篇文章,发现了影像学评估的局限性,并证实辅以ctDNA液体活检可以更好地评估肿瘤免疫治疗的疗效。采用ctDNA变化谱来识别假性进展的敏感度为90%,特异性达到了100%[13]。
irAE
ICIs治疗是通过利用机体自身的免疫系统杀伤肿瘤,由于免疫系统功能的恢复,可能导致irAE[14]。irAE是指由调节T细胞活性所导致的免疫激活,可引起免疫相关的不良反应,从而引起相应器官的相关症状[15]。
irAE与传统化疗的不良反应谱不同[16]:ICIs毒性多发生于胃肠系统、肌肉关节系统、心血管系统、呼吸系统、神经系统、内分泌系统和血液系统,肝脏、肾脏、皮肤、眼睛等器官也会出现相应毒性,是以脏器表现为主导。以atezolizumab为例, 多发的irAE为食欲下降、吞咽困难、恶心、腹泻、发热、关节骨骼痛、失眠、肺炎、甲状腺功能减退;最常见的3级或4级irAE有吞咽困难、肺炎、关节骨骼痛等。
而消统化疗多西他赛多发的不良反应则为脱发、恶心、腹泻、无力、食欲下降、吞咽困难、发热、关节痛、肌痛、中粒细胞减少、周围神经病变、外周感觉神经病变、发热性中性粒细胞减少,3级或4级AE为中粒细胞减少、发热性中性粒细胞减少、腹泻、外周感觉神经病变、无力、肌痛等。
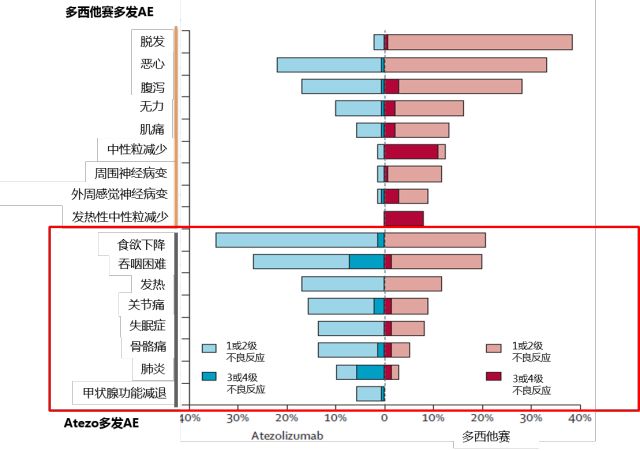
图9. irAE与传统化疗的不良反应谱不同
irAE的整体发生率低于化疗、耐受性良好:POPLAR研究显示16,atezolizumab治疗相关AE发生率为67%,而多西他赛则为88%;CheckMate 017/057研究中,nivolumab治疗相关AE发生率分别为58%和69%,而多西他赛则为86%-88%;Keynote-010研究中,不同剂量的pembrolizumab治疗相关AE发生率分别为63%和66%,而多西他赛则为81%。整体的3级或4级AE,免疫检查点抑制剂为7%-13%,而多西他赛则达到35%-55%。
大部分irAE是可逆的:大体irAE在1-6个月内发生,但是大部分irAE是可逆的,暂停给药后随着时间逐渐缓解,也可应用糖皮质激素或免疫抑制剂控制。
irAE在不同系统的发生时间、缓解时间不同:不同部位的irAE的发生时间不同,例如,pembrolizumab的毒性出现的先后顺序为肝脏>肺炎>肠炎>甲减>甲亢>严重皮肤毒性,ipilimumab的皮肤毒性通常用药后2-3周开始出现、胃肠道毒性通常用药后5周左右出现、肝脏和内分泌毒性通常用药后6-7周出现[17]。
irAE在不同系统的缓解时间也不同。比如,在nivolumab的irAE中,胃肠和肝脏毒性缓解时间较快(缓解只需2周左右),内分泌事件需要的缓解时间较长,可能需要20.6周左右[18]。
总结
6月15日,中国第一个肿瘤ICIs——欧狄沃获批上市(纳武利尤单抗注射液,nivolumab),这也标志着中国进入免疫治疗“元年”。而面对ICIs不同于传统肿瘤治疗的特征,如何合理地、更好地判定肿瘤免疫治疗的疗效,充分认识其临床优势;如何更正确地管理irAE,避免因不良反应影响疗效;以及如何进一步让肿瘤免疫治疗精准化,为以后的个体化肿瘤免疫治疗奠定基础,在未来还有很长的路要探寻。
参考文献:
1.Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle.Immunity. 2013 Jul 25;39(1):1-10.
2.Vanderlugt CL, Miller SD. Epitope spreading in immune-mediated diseases: implications for immunotherapy.Nat Rev Immunol. 2002 Feb;2(2):85-95.
3.Kaech S, Cui W. Transcriptional control of effector and memory CD8+ T cell differentiation.Nat Rev Immunol 2012;11(12):749-61
4.http://abstracts.asco.org/214/AbstView_214_218423.html
5.Wang Q, Gao J, Wu X. Pseudoprogression and hyperprogression after checkpoint blockade. Int Immunopharmacol. 2018 May;58:125-135.
6.Katz SI, Hammer M, Bagley SJ,et al. Radiologic Pseudoprogression during Anti-PD-1 Therapy for Advanced Non-Small Cell Lung Cancer. J Thorac Oncol. 2018 May 5. pii: S1556-0864(18)30536-7.
7.ASCO2017,abstract 9001.
8.Long GV, Weber JS, Larkin J,et al. Nivolumab for Patients With Advanced Melanoma Treated Beyond Progression: Analysis of 2 Phase 3 Clinical Trials. JAMA Oncol. 2017 Nov 1;3(11):1511-1519.
9.WolchokJD, Hoos A, O'Day S,et al. Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin Cancer Res. 2009 Dec 1;15(23):7412-20.
10.Eisenhauer EA, Therasse P, Bogaerts J,et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1).EurJ Cancer. 2009;45(2):228-247.
11.Topalian et al, Clin Oncol 2013; 31(suppl): abstr 3002.
12.Chiou VL, Burotto M. Pseudoprogression and Immune-Related Response in Solid Tumors. J Clin Oncol. 2015 Nov 1;33(31):3541-3.
13.Lee JH, Long GV, Menzies AM,et al. Association Between Circulating Tumor DNA and Pseudoprogression in Patients With Metastatic Melanoma Treated With Anti-Programmed Cell Death 1 Antibodies. JAMA Oncol. 2018 May 1;4(5):717-721.
14.Borghaei H, Smith MR, Campbell KS. Immunotherapy of cancer. Eur J Pharmacol. 2009 Dec 25;625(1-3):41-54.
15.Amos SM, Duong CP, Westwood JA,et al. Autoimmunity associated with immunotherapy of cancer.Blood. 2011;118(3):499-509.
16.Fehrenbacher L, Spira A, Ballinger M,et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet. 2016 Apr 30;387(10030):1837-46.
17.Weber JS, Kähler KC, Hauschild A. Management of immune-related adverse events and kinetics of response with ipilimumab.J Clin Oncol. 2012;30:2691–2697.
18. Eigentler TK, Hassel JC, Berking C, et al. Diagnosis, monitoring and management of immune-related adverse drug reactions of anti-PD-1 antibody therapy. Cancer Treat Rev. 2016 Apr;45:7-18.(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发