Nature丨迟洪波组报道免疫与线粒体能量代谢的连接纽带
| 导读 | CD8α+树突状细胞将抗原提呈给CD8+T细胞并诱导细胞毒T细胞对抗病毒、病原体及肿瘤细胞【1】。CD8α+树突状细胞发育相关的一系列转录调控因子相继被发现【2】 |
1973年,Steinman和Cohn在观察脾脏细胞时发现了一类细胞, 因其具有树突的形态故命名为树突状细胞(dendritic cells, DCs)。DC是目前已知的功能最强的专职抗原提呈细胞(antigen presenting cells, APCs),其膜表面高表达MHC-II类分子,能有效刺激初始型T细胞活化, 其抗原提呈能力远强于巨噬细胞和B细胞。因此,DC是机体免疫应答的主要启动者, 在肿瘤免疫中亦发挥关键作用。树突状细胞广泛分布于脑以外的全身组织和脏器,数量较少,仅占人外周血单个核细胞的1%,根据来源,可将DC 分为两类,即来源于髓系干细胞的髓样树突状细胞(myeloid DC)和来源于淋巴系干细胞的淋巴样树突状细胞 (lymphoid DC)。
CD8α+树突状细胞将抗原提呈给CD8+T细胞并诱导细胞毒T细胞对抗病毒、病原体及肿瘤细胞【1】。CD8α+树突状细胞发育相关的一系列转录调控因子相继被发现【2】,但CD8α+如何发挥其生物功能的相关信号通路研究甚少。此外,代谢重编程在树突状细胞发育及激活中扮演至关重要的角色【3, 4】,树突状细胞中代谢依赖的相关调控因子研究亦甚少。
近日,来自St. Jude儿童研究医院迟洪波组与Jiyang Yu组合作在Nature上发表了题为Hippo/Mst signalling couples metabolic state and immune function of CD8α+ dendritic cells研究论文,报道了Hippo信号通路关键因子MST1/2在CD8α+树突状细胞中调控代谢及免疫功能的相关机制。

Mst1/2是Hippo信号通路关键组分,在细胞增殖、凋亡、免疫中均扮演重要角色【5】。2012年Basile组报道病人初始T细胞中MST1缺失导致FOXO1、BCL2表达降低并引发初始T细胞凋亡及免疫缺陷发生【6】。Mst1在调节型T细胞发育中亦扮演重要角色,MST1/2通过调控FOXO1/3蛋白稳定性进而影响调控性T细胞发育及功能【7】。
在最新的这项研究中,研究人员采用系统生物学分析的方法并开发出NetBID这一整合转录组学、蛋白组学、磷酸化修饰组学研究利器进行相关研究(下图)。
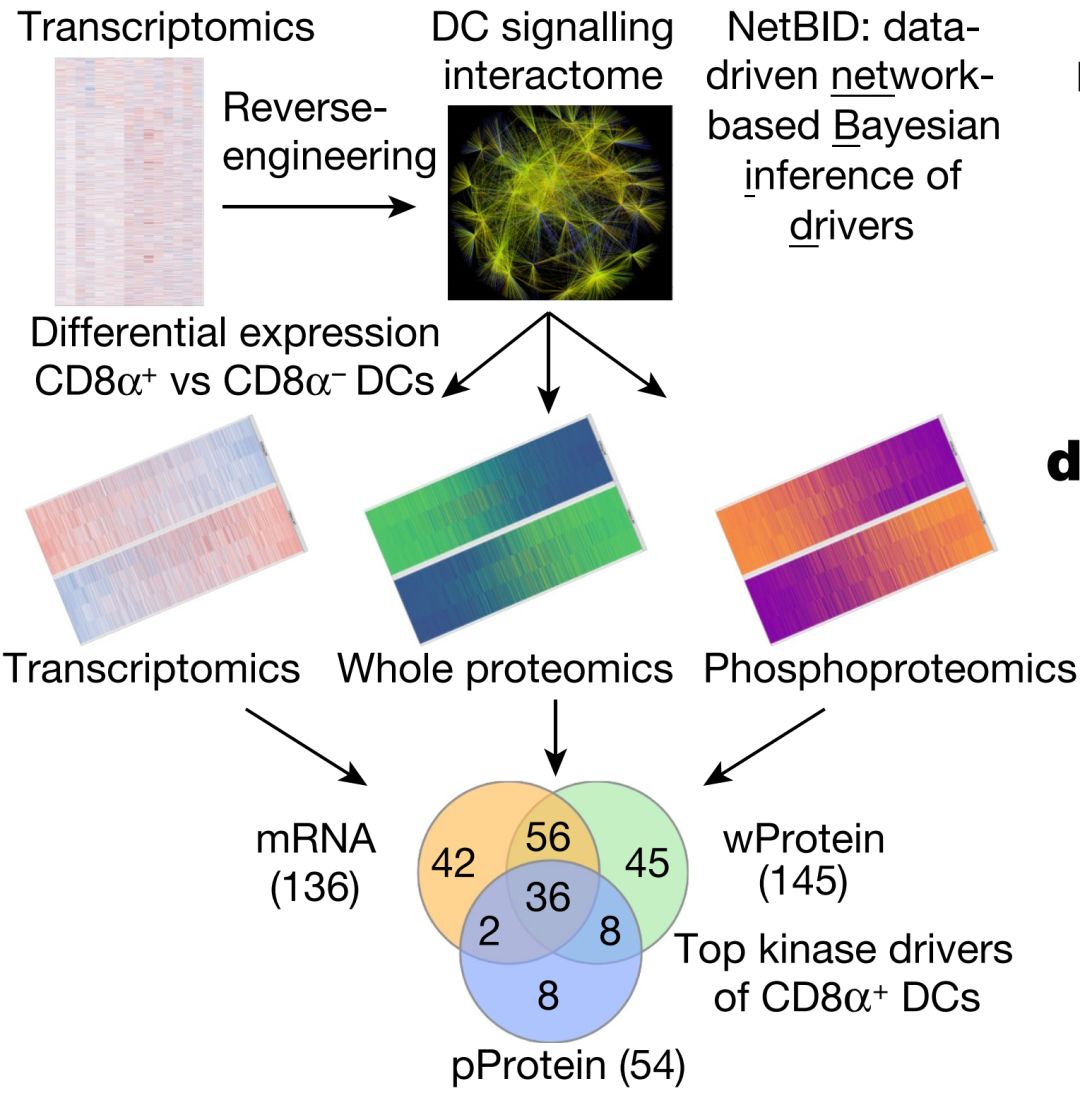
NetBID的工作机制
研究人员发现CD8α+树突状细胞中MST1表达量较CD8α-组增加数倍,hippo下游相关组分亦发生明显变化,此结果揭示MST1在CD8α树突状细胞中可能扮演重要角色。在树突状细胞特异性敲除MST1/2的小鼠模型中,CD8+T细胞免疫应答较正常组减弱这表明该MST1信号通路对CD8+T细胞免疫应答是至关重要的。
代谢重编程影响树突状细胞发育与激活,但代谢相关蛋白如何调控树突状细胞功能远远没有一个清晰的认识。该文研究人员发现特异性敲除MST1/2的树突状细胞CD8α+中线粒体形态发生改变,线粒体发生聚集、线粒体增大,线粒体嵴组织紊乱(与氧化磷酸化密切相关)但CD8α−树突状细胞线粒体却没有明显的变化。【8, 9】线粒体融合断裂动态变化与氧化磷酸化密切相关【10】,在CD8α+树突状细胞中线粒体融合蛋白OPA1蛋白减少并且线粒体分裂蛋白DRP1磷酸化水平降低(下图)上述结果表明MST1/2可通过调控线粒体结构与功能影响能量代谢并管控CD8α+树突状细胞功能。
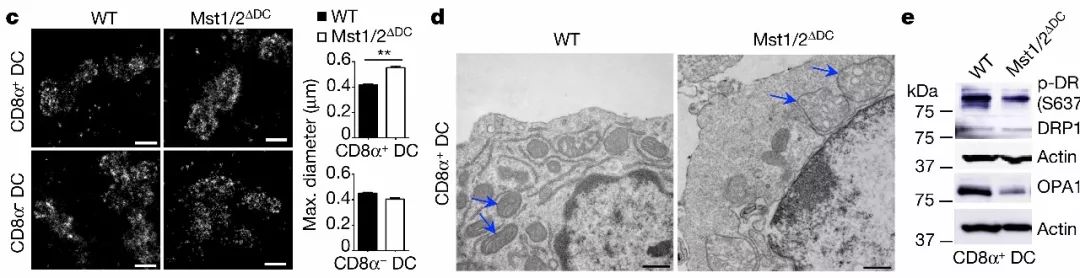
CD8α+树突状细胞中线粒体融合蛋白OPA1蛋白减少并且线粒体分裂蛋白DRP1磷酸化水平降低
研究人员通过基因富集分析发现,树突状细胞中IL-12信号通路受MST1/2影响最大。敲除MST1/2的树突状细胞中IL-12 mRNA水平较较对照组降低许多,在MST1/2敲除的OT-I细胞中过表达IL-12可以部分回复树突状细胞表型。这从细胞水平进一步证实MST1/2可能参与调控IL12信号通路。Western Blot检测发现NF-kB信号通路的相关因子NF-Kb2、RelB蛋白量变化明显,这揭示MST1/2可能通过调控NF-kB信号通路进而影响IL-12产生从而刺激T细胞激活。
总的来说,该研究首次揭示Hippo/MST信号通路在树突状细胞如何发挥功能,将线粒体能量代谢与免疫紧密结合在一起,将Hippo/MST信号通路研究从T细胞拓展到树突状细胞,丰富了Hippo/MST信号通路的功能。整个实验依托强大的组学分析,找到精确的CD8α+树突状细胞关键调控通路,表型显著、实验数据十分详实。该研究表明MST1/2信号通路可以作为肿瘤治疗及免疫疾病的新治疗干预靶点。

迟洪波教授是免疫代谢领域的杰出华人学者,主要从事T细胞所介导的适应性免疫的信号和代谢通路研究,在T细胞命运和功能研究中解析免疫信号和细胞代谢的相互作用以及树突状细胞介导的T细胞反应的外部控制信号方面取得了突出的学术成绩。近5年作为通讯作者在包括Nature(3篇)、Immunity(3篇)、Nature Immuology(3篇)、JEM、JCI等杂志上发表十多篇研究论文。
参考文献
1 Merad M, Sathe P, Helft J, et al. The dendritic cell lineage: ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting[J]. Annual Review of Immunology, 2013, 31(5):563-604.
2 Izumi Sasaki, Tsuneyasu Kaisho. Transcriptional Control of Dendritic Cell Differentiation[J]. Current Topics in Microbiology and Immunology, 2014, 381(2):454-457.
3 Edward J. Pearce, Bart Everts. Dendritic cell metabolism[J]. Nature Reviews Immunology, 2015, 15(1):18-29.
4 O’Neill L A J, Pearce E J. Immunometabolism governs dendritic cell and macrophage function:[J]. Journal of Experimental Medicine, 2016, 213(1):15-23.
5 Jacob A. Galan, Joseph Avruch. The MST1/MST2 Protein Kinases: Regulation and Physiologic Roles[J]. Biochemistry, 2016, 55(39).
6 Nehme N T, Pachlopnik S J, Debeurme F, et al. MST1 mutations in autosomal recessive primary immunodeficiency characterized by defective naive T-cell survival.[J]. Blood, 2012, 119(15):3458-68.
7 Du X, Shi H, Li J, et al. Mst1/Mst2 Regulate Development and Function of Regulatory T Cells through Modulation of Foxo1/Foxo3 Stability in Autoimmune Disease[J]. Journal of Immunology, 2014, 192(4):1525-35.
8 Cogliati S, Frezza C, Soriano M E, et al. Mitochondrial cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency.[J]. Cell, 2013, 155(1):160-171.
9 Buck M D, O'Sullivan D, Klein Geltink R I, et al. Mitochondrial Dynamics Controls T Cell Fate through Metabolic Programming[J]. Cell, 2016, 166(1):63-76.
10 Mishra P, Chan D C. Metabolic regulation of mitochondrial dynamics.[J]. Journal of Cell Biology, 2016, 212(4):379.(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发