FDA加速清除孤儿药申请积压,目前成效显著
| 导读 | 2017年FDA加速清除积压的孤儿药申请之后,孤儿药的上市速度明显加快,2017年全年共获批77个孤儿药创历史新高。 |
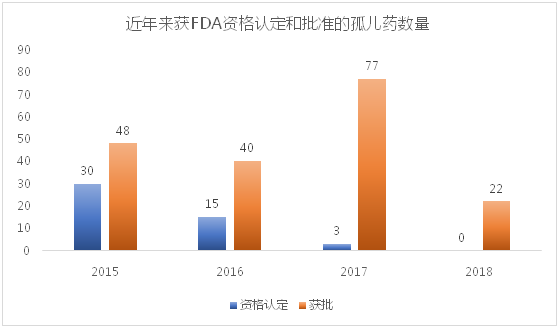
2017年FDA加速清除积压的孤儿药申请之后,孤儿药的上市速度明显加快,2017年全年共获批77个孤儿药创历史新高。
自1983年美国国会通过孤儿药法案以来,截至2018年5月15日,FDA共批准了496种孤儿药,其中有266种只能用于唯一适应症,获批适应症和疗法最多的ibrutinib先后有16种适应症或疗法获得FDA的孤儿药资格认定,并成功获批了其中的10种,包括了慢性淋巴细胞白血病(CLL)、套细胞淋巴瘤、淋巴结边缘区淋巴瘤等。

数据显示,2013年开始,FDA每年批准的孤儿药数量相较于往年有了很大的增长,尤其是2017年,虽然获得孤儿药资格认定的药品数量急剧下降,但是获批的孤儿药数量达到了前所未有的77个,这得益于FDA新局长上台之后承诺的在120天内完全消除积压的大约200个孤儿药认定请求。FDA还将推行新政策以提高审查程序的效率,确保在90天内完成审查以避免积压现象的出现。
从2017年至今获批孤儿药的次数来看,诺华是最大的赢家,共获得14次孤儿药上市许可,包括两对组合疗法;罗氏旗下基因泰克公司有6个药品获批,其中Rituxan(利妥昔单抗和人透明质酸酶)皮下注射剂被批准用于滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤和慢性淋巴细胞性白血病三种适应症;BMS获批的3种药物,其中重磅药物PD-1单抗Opdivo分别被批准用于IIb至IV期黑素瘤、霍奇金氏淋巴瘤和肝细胞癌的治疗;由Pharmacyclics和强生共同开发的重磅药物Imbruvica先后获得了慢性淋巴细胞白血病(CLL)、套细胞淋巴瘤等四项孤儿药资格认定。

2017年至今,有13款药物获批了多种适应症,严格来说应该是包含了两对组合疗法,其中,重磅药物众多,包括重磅白血病新药Imbruvica、PD-1单抗Opdivo、PD-L1抑制剂Keytruda等。

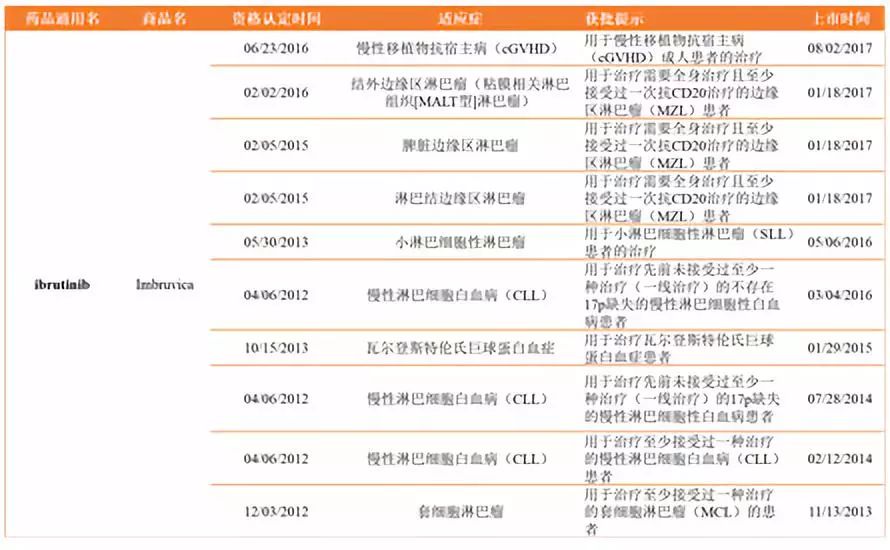
Imbruvica(依布替尼ibrutinib)是Pharmacyclics/Johnson & Johnson共同开发的BTK抑制剂,于2013年顺利获批上市用于套细胞淋巴瘤(MCL)的治疗,先后获得国FDA授予的四项突破性疗法认定以及孤儿药资格认定和优先审评资格。
Imbruvica上市后销售额突飞猛进,也使得AbbVie于2015年3月斥资210亿美元重金收购了Pharmacyclics,获得了其美国市场商业权利。强生最早于2013/9/6(CDE承办时间)在中国提交了伊布替尼的注册申请,2016/11/7提交了生产申请,2016/12/2获得以“与现有治疗手段相比具有明显治疗优势”的理由被CDE纳入优先审评,2017/8/28获得CFDA颁发的生产批件。
Imbruvica(ibrutinib)已获批适应症及用法
Adcetris(brentuximab vedotin)是Seattle Genetics公司开发的一种将抗CD30单克隆抗体和微管破坏剂MMAE(monomethylauristatin E)通过蛋白酶切割型连接键联接起来的抗体药物偶联物(ADC)。
2017年10月,Adcetris获FDA突破性疗法资格认定,作为与其他化疗药物联合使用的一线组合疗法,治疗晚期经典霍奇金淋巴瘤。2018年3月,该药获FDA批准用于治疗先前未经治疗的III期或IV期经典霍奇金淋巴瘤(cHL)患者,与G-CSF(一种促进骨髓白细胞生长的生长因子)的化疗组合被FDA推荐用于III期或IV期经典霍奇金淋巴瘤的一线治疗。该药此前还被批准用于治疗已接受过全身治疗的CD30表达的蕈样肉芽肿成年患者以及曾接受全身治疗的原发性皮肤间变性大细胞淋巴瘤成年患者。
BMS 的Opdivo是世界上首个获得批准的PD-1免疫检查点抑制剂。该药物目前已在包括美国、欧盟和日本的60多个国家获得批准。2015年10月,Opdivo和Yervoy联合用药方案成为首个获得批准治疗转移性黑色素瘤的联合免疫疗法。该联合疗法目前已获得包括美国和欧盟在内的50多个国家的批准。2018年4月17日,Opdivo和Yervoy联合免疫疗法又一次获得FDA批准,而这次成为了首款用于初治的中高危晚期肾细胞癌(RCC)患者的联合免疫疗法。
2017年Opdivo收入达到49.4亿美元,同比增长31%,远远领先于默沙东公司的Keytruda。2017年年底,Opdivo进入了内地CFDA机构的上市审批程序,正式踏上在内地的上市之路,这是首款将要引入内地的肿瘤免疫药物。
Yescarta(Axicabtageneciloleucel)是继Kymriah后第二款获批的CAR-T疗法,同时也是首个针对特定类型非霍奇金淋巴瘤的基因疗法。Yescarta被批准用于治疗对其他疗法无响应或接受过至少2种治疗方案后复发的特定类型成人大B细胞淋巴瘤患者,包括弥漫性大B细胞淋巴瘤(DLBCL)、转化型滤泡性淋巴瘤(TFL)和原发纵膈B细胞淋巴瘤(PMBCL)。
2017年8月28日,Gilead与Kite制药联合宣布,双方董事会已经达成最终收购协议,前者将以每股180美元的现金价格收购Kite,溢价29%。本次收购使Gilead成为CAR-T疗法的第三大巨头。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发