【抗体药事】“A股药王”布局一系列抗体新药,恒瑞会成为中国抗体一哥吗?
| 导读 | (国家食品药品监督管理总局药品审评中心)发布了第二十八批拟纳入优先审评程序药品注册申请的公示名单,4个抗PD-1单抗产品赫... |
近日,CDE(国家食品药品监督管理总局药品审评中心)发布了第二十八批拟纳入优先审评程序药品注册申请的公示名单,4个抗PD-1单抗产品赫然在列,包括恒瑞医药的注射用卡瑞利珠单抗(SHR-1210)、君实生物的特瑞普利单抗注射液(JS001)、信达生物的信迪利单抗注射液(IBI308)和唯一一款来自外籍默沙东的帕博利珠单抗注射液(Keytruda),登上这批优先审评“荣誉榜”的入选理由为“与现有治疗手段相比具有明显治疗优势”。
CDE方面表示:“一旦获得优先审评资格,将在技术审评、药品检验、生产现场核查、临床核查等各个环节予以优先。”业内普遍预计,这些备受期待的重磅品种有望于今年内陆续获批上市,填补中国市场的空白。
显而易见,恒瑞医药、君实生物、信达生物都成为PD-1抗体的第一梯队,三家不分伯仲,处于贴身肉搏的激烈竞争中。其中“A股药王”恒瑞一直在抗肿瘤领域深耕不辍,是国内知名的抗肿瘤产研销结合的供应商,担任国家抗肿瘤药技术创新产学研联盟牵头单位,并建有国家靶向药物工程技术研究中心。最新数据显示其去市值已逼近2500亿,增长势头迅猛。

其实恒瑞去年市值已突破2000亿,当之无愧地成为医药“市值一哥”。4月28日,恒瑞医药公布了2018年第一季度财务报表,不论从总资产还是同比营业收入都比2017年有所增长,分别是4.78%和21.70%。恒瑞2017年年报显示,全年营业收入138.36亿元(+24.72%),归属于上市公司股东的净利润为32.17亿元(+24.25%),扣非净利润为31.01亿元(+19.76%)。
资料显示,恒瑞主营主要产品涵盖抗肿瘤药、手术麻醉类用药、特殊输液、造影剂、心血管药等众多领域,但抗肿瘤药依然占据利润大头,成为所有业务中毛利最高的支柱板块。
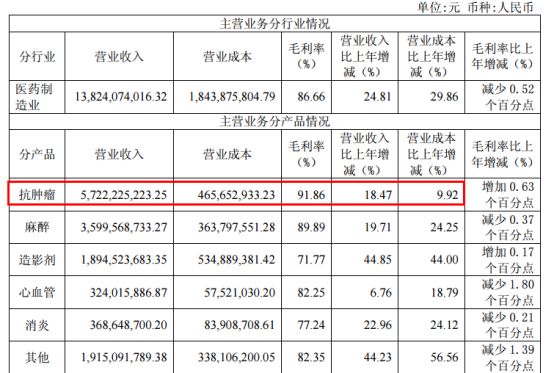
在恒瑞抗肿瘤药中,热度持续走高的抗PD-1和抗PD-L1抗体也被列为企业重点发展对象。首先发展PD-1/PD-L1单抗符合肿瘤制药巨头的定位,其次作为市值一哥,有足够的财力支撑耗资巨大的新药研发,最后抗体药等生物药是全球药企争抢的战略高地,已是时代发展趋势,所以A股医药龙头的恒瑞自然要与时俱进、紧跟潮流。
能看到,近两年伴随生物技术的颠覆性革命创新,各类生物大分子药物特别是抗体类药物的研发已经成为全球热点,新型抗体药物如抗体偶联物、双特异性抗体、纳米抗体、肿瘤免疫疗法等都是抗体药物研发的新趋势。PD-1/PD-L1等单抗药物具有靶向性强、特异性高和毒副作用低等优点,因此在抗肿瘤、 自身免疫、心血管和神经系统疾病等领域具有无限广阔的应用前景。
据Evaluatepharma 数据,目前抗体药物占整个生物技术药物市场份额 40%左右,并且市场份额还在继续增长,预计到 2022 年全球抗体药物的销售额将达到 1708 亿美元,在生物技术药中的比例将上升至 52%。
而在肿瘤免疫治疗领域,PD-1/PD-L1抑制剂市场前景也非常广阔。据Research and Markets报告显示,2025年PD-1/PD-L1抑制剂将以23.4%的年均复合率增长,预计峰值能达到350亿美元,正是庞大的市场吸引恒瑞等企业纷纷加入PD-1/PD-L1单抗开发行列。
恒瑞的PD-1抗体最知名的莫过于SHR-1210(卡瑞利珠单抗),据报道2017年3月,在WHO公布的第77期药物信息目录中,恒瑞的PD-1单抗被收录其中,非专利药物名(INN)为“Camrelizumab SHR-1210”。恒瑞PD-1单抗成为继康弘药业的第2个获得WHO 非专利药物名的国产生物药,同时也是首个获得WHO非专利药物名的国产抗体药物。
目前SHR-1210最快进展是在非小细胞肺癌、食管癌中开展临床三期,在肝细胞癌、霍奇金淋巴瘤、黑色素瘤、鼻咽癌等方面也在进行相应临床,可见适应症也十分广泛。2015年,恒瑞还将SHR-1210有偿许可给美国Incyte公司,总金额达7.95亿美元。
然而事情进展并不顺利,Incyte在随后的临床实验中,发现SHR-1210与一种独特而温和的副作用——1级和2级的血管瘤(一种小的非癌性的血管皮肤增生)有关,该结果还发布在《Phase I study of the anti-PD-1 antibody SHR-1210 in patients with advanced solid tumors》文章中,文章公布58名患者不良反应情况,有79.3%的受试者出现反应性毛细血管瘤症状,为此Incyte不得不遗憾地中断SHR-1210的继续实验,并转向新的合作伙伴MacroGenics,与MacroGenics达成9亿美元的PD-1抗体制剂的新协议。
虽然SHR-1210在海外遭遇些许挫折,但并未影响其在国内PD-1抗体的领先地位,目前仍在多个癌种中进行受试者招募与临床试验,迄今为止,恒瑞已经为PD-1投入11.2亿元左右资金。
除了SHR-1210,在抗PD-L1药物方面,恒瑞还自主研发了SHR-1316。2017年12月14日,公司发公告,称人源化抗 PD-L1单抗SHR-1316注射液已获CFDA批准进行临床试验,同样用于恶性肿瘤的治疗。截止当时,恒瑞在SHR-1316注射液研发上已投入约3400万元。
外界评价,恒瑞的PD-1/PD-L1抗体研发显示出公司在生物药与类似物领域的全新布局,恒瑞不仅是“市值一”,还是“研发一哥”,在国内临床试验管理以及肿瘤产品线商业化方面的一流实力,定会让抗体药的全球竞技场变得更加热闹非凡。
实际上,贝伐单抗生物类似物近年来也成为各大药企激烈角逐的对象。贝伐单抗由罗氏子公司基因泰克等企业联合开发,也是一种人源化的抗-VEGF 单抗,2004 年FDA就批准了该药物的上市申请,2017 年其全球市场的销售额为 68.08亿美元,其中中国市场贡献的销售额为1亿美元,占比大约为1.5%。
目前不少国内制药企业针对贝伐单抗进行仿制开发,恒瑞也是众多选手之一,主要适应症是非小细胞肺癌,但实际上贝伐单抗治疗范围很广,转移性结直肠癌、恶性胶质瘤、转移性肾细胞癌、宫颈癌和卵巢癌等都有疗效,因此该款药物被称为抗肿瘤的"多面手"。
不仅研发单一抗体,恒瑞还在此基础上开发抗体毒素偶联物。抗体偶联药物(Antibody-drug Conjugate ,ADC)是拥有强细胞毒性的化疗药物,通过连接物与单抗偶联形成的,兼具小分子药物强大的杀伤力和纯单抗高度的靶向性。
2017年恒瑞财报显示,恒瑞的创新模式从初期“me-too”、“me-better”逐步走向源头创新,创新药布局也从小分子向大分子药物转化,产生了具有自主知识产权的ADC技术平台,并率先在国内申请国际领先的ADC“生物导弹”。
例如,注射用SHR-A1201是恒瑞2013年申报的ADC,目前已经进入临床阶段;2017年恒瑞的另一款抗体药物偶联体——注射用SHR-A1403,还经FDA批准开展药物临床试验,成为国内首个获得美国FDA批准临床的ADC药物。
恒瑞董事总经理周云曙曾表示,“恒瑞医药有三个梦想:第一个是产品即制剂出口海外;第二个是具有创新意义的创新药在中国上市;第三个是真正意义的原研创新药在全球上市。”由此看来,“一哥”恒瑞的确在踏实践行企业的愿景,奋力奔跑在梦想的道路上,距离成功也越来越近。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发