《Nature》、《Science》双王炸:张锋升级系统!新基因编辑系统诞生!
| 导读 | 近日,两项重大的突破性的研究在《Nature》和《Scinece》上报道。一个由张锋团队主导,发现了可编辑RNA的新分子,而另一个研究由麻省理工学院广泛研究所和马萨诸塞州剑桥的哈佛分校David Liu教授实验室主导:新基因编辑系统!
|
基因编辑前景无限
导 读
近日,两项重大的突破性的研究在《Nature》和《Scinece》上报道。一个由张锋团队主导,发现了可编辑RNA的新分子,而另一个研究由麻省理工学院广泛研究所和马萨诸塞州剑桥的哈佛分校David Liu教授实验室主导:新基因编辑系统!
《Nature》:新编辑技术!DNA无断裂即可进行碱基互换!
麻省理工学院广泛研究所和马萨诸塞州剑桥的哈佛分校开发,David Liu教授实验室主导开发出了一个新的基因编辑系统!与原始的CRISPR基因编辑系统不同,这是一种相对不可预测和平坦的分子剪刀形式,可以剪切DNA的相当大的部分——可以重写单个字母或遗传基因从而具备了可改变单一基因的能力。
而这意味着研究人员现在可以尝试纠正超过一半的人类遗传性疾病!
这篇文章发表在10月25日的《Nature》上,David Liu教授实验室发表了一篇名为“Programmable base editing of A•T to G•C in genomic DNA without DNA ”文章,一石激起千层浪!
Nature报道
这篇文章中报道了一种新型腺嘌呤碱基编辑器 (ABE),结合以前的技术,ABE可以将A—T碱基对转换成G—C碱基对,也可以将G—C碱基对转换成T—A 碱基对!
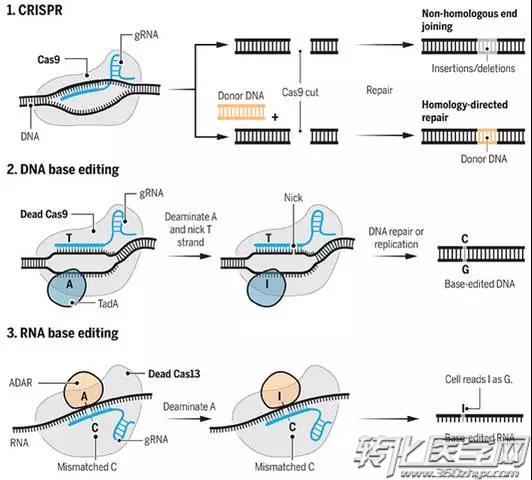
Getting to the point of mutations
Base editors borrow from CRISPR's components—guide RNAs (gRNAs) and Cas9 or other nucleases—but don't cut the double helix and instead chemically alter single bases with deaminase enzymes such as TadA and ADAR.
这个技术到底突破在哪里?
ABE实现了在不依赖DNA断裂的情况下就能够将DNA中四种不同的A、T、G、C碱基进行替换!这种新型的技术在那些人类遗传病中由碱基对发生突变而导致的疾病有着不可估量的作用!
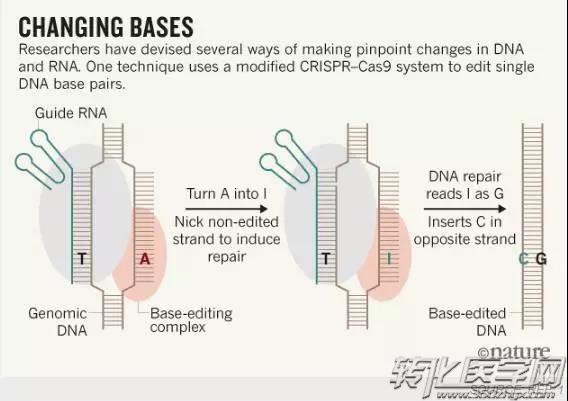
ABE编辑技术
而在这项研究中,在人胚胎肾细胞和骨癌细胞中,该技术以约50%的效率和几乎没有可检测的副产物进行了研究人员所需要进行的校正!相比之下,更传统的基于CRISPR的方法,其中科学家插入含有所需碱基变化的DNA链,固定相同的单碱基差异小于5%的效率,并且经常引起在编辑过程中不希望出现的大块DNA的插入或缺失。
首尔国立大学分子遗传学家Jin-Soo Kim说:“这是基因组编辑领域的重大突破!”
盐湖城犹他大学的基因工程研究员达纳·卡罗尔(Dana Carroll)表示:“这代表了英勇的努力,他指出,定向进化方法是黑暗中的一个镜头。卡罗尔说:“我不会有胆量去尝试他们所做的。”
“A到G,G到A,C到T和T到C”的四种类型的能力对于精确的治疗和基因编辑将是非常有价值的,“中国北京科学院遗传与发育生物学研究所植物遗传学家Caixia Gao说道。

Science报道
Cas13酶家族最近受张锋团队青睐。10月4日,在发表于《自然》期刊的论文上,张锋团队证实了另一种酶Cas13a能够在哺乳动物细胞中特异性地下调内源性RNA和报告RNA的水平。
“基因编辑的首要目标是矫正导致疾病的突变。现在,我们已经很擅长让基因失活,但要修复已丢失的蛋白质功能则更具挑战得多。编辑RNA这一新技能打开了更多的可能,几乎可以在所有细胞中修复蛋白质功能,有助于多种疾病治疗。”张锋表示。
和此前CRISPR系统用于编辑DNA不同,张锋团队在普雷沃氏细菌(Prevotella)中找到了PspCas13b酶。这是Cas13酶家族中能使RNA失去活性的“佼佼者”,是潜在的RNA“剪刀”。
但张锋团队赋予PspCas13b的“使命”不是去让RNA失活,相反的,他们设计了PspCas13b的“变体”。这个“变体”失去了“剪刀”的功能,但会牢牢地结合在特定的RNA片段上。同时,PspCas13b“变体”的搭档——ADAR2蛋白会将该片段上的腺嘌呤核苷(A)替换成次黄嘌呤核苷(I)。
为何要做此替换?原来,鸟嘌呤核苷(G)突变为腺嘌呤核苷(A)时有发生,而这被认为和杜氏肌营养不良症、帕金森病等疾病密切相关。
人类的很多疾病信息都编码在DNA这个“生命脚本”上。基因编辑技术的出现使得科学家有了修改DNA的可能,给治愈疾病带来希望。但由于基因承载着生命最根源的信息,对DNA进行编辑有着安全和伦理上的顾虑。
RNA编辑有所不同。RNA是以DNA单链为模板的遗传信息载体。DNA发出 “错误指令”,经RNA转录,翻译给蛋白质并执行功能,才有疾病的表现。若中途拦截,矫正RNA上的错误信息,让蛋白质接收到正确的信息,可起到治疗效果。
Zhang和Liu强调,基础编辑治疗进入临床试验之前可能需要几年时间,还需要明确该方法是否具有优于现有基因治疗的优势。然而,已经明确的是,标准CRISPR的强大变体已经存在于现如今的基因治疗体系。
不得不说:基因编辑使得未来充满无限可能!
参考资料:
1、CRISPR hacks enable pinpoint repairs to genome
2、Novel CRISPR-derived ‘base editors’ surgically alter DNA or RNA, offering new ways to fix mutations
3、New Version of CRISPR, Developed by Feng Zhang-Led Team, Can Target and Edit RNA
4、Programmable base editing of A•T to G•C in genomic DNA without DNA cleavage
(转化医学网360zhyx.com)

-
 游客2017-10-31 14:14:19一楼说的对
游客2017-10-31 14:14:19一楼说的对 -
 游客2017-10-27 10:57:20治病救人优先,伦理应放在后面。
游客2017-10-27 10:57:20治病救人优先,伦理应放在后面。
 正在加载
正在加载 腾讯登录
腾讯登录