永不止步的征程——肺癌靶向治疗
| 导读 | 2009年公布的IPASS研究揭开了肺癌分子靶向治疗的序幕,开启了肺癌靶向治疗的征程。此后,围绕具有特定分子突变人群的靶向治疗临床研究遍地开花,证实了特定基因变异状态对靶向药物疗效的预测作用,开启了肺癌精准医疗的大门。 |
2009年公布的IPASS研究揭开了肺癌分子靶向治疗的序幕,开启了肺癌靶向治疗的征程。此后,围绕具有特定分子突变人群的靶向治疗临床研究遍地开花,证实了特定基因变异状态对靶向药物疗效的预测作用,开启了肺癌精准医疗的大门。
【映日荷花别样红:EGFR-TKI,创新不止】
EGFR基因突变是肺癌靶向治疗的重要靶点,我国非小细胞肺癌(NSCLC)患者约50%的患者携带EGFR突变。多项大型III期临床试验均已证实在EGFR基因突变阳性的NSCLC患者的一线治疗中,EGFR-TKI和化疗相比表现出更显著的疗效、更低的毒副作用及更优异的生存质量。EGFR-TKI(如gefitinib、erlotinib或afatinib)已成为各大指南中推荐的EGFR基因突变阳性患者的一线治疗方案。

Wu YL., Ke EE. Trends Pharmacol Sci. 2016 Nov;37(11):887-903.
EGFR-TKIs治疗为EGFR基因突变阳性的NSCLC患者带来临床获益的同时,EGFR-TKI的获得性耐药也不可避免。一代EGFR-TKI最常见的继发耐药机制是EGFR基因的二次突变,其中T790M突变约占50-60%。三代EGFR-TKIs是一种不可逆的针对EGFR T790M及敏感突变的抑制剂,对EGFR基因野生型患者无明显作用。其中osimertinib针对EGFR-TKI治疗后耐药的T790M突变患者已表现出显著地治疗应答,mPFS达10.1个月,同时该药还因可穿透血脑屏障成为脑转移患者的治疗选择。
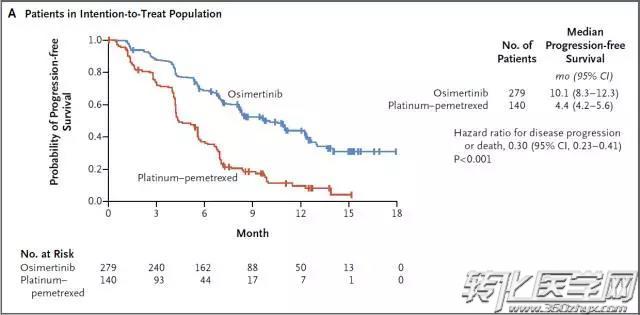
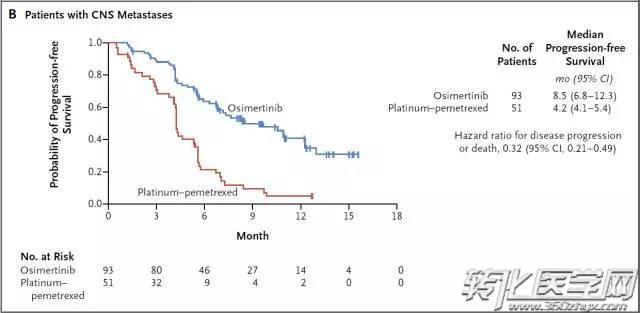
Mok TS et al. N Engl J Med. 2017 Feb 16;376(7):629-640.
从一代EGFR-TKI到三代EGFR-TKI,针对EGFR基因突变阳性NSCLC患者的药物和治疗决策的创新并未止步,更多的EGFR-TKI药物,如达克替尼、olmutinib等的研究、EGFR-TKI在早期肺癌领域的拓展应用研究、奥希替尼的一线研究和脑转移患者标准治疗方案的研究、三代EGFR-TKI耐药后治疗决策研究等,进一步开拓了EGFR基因突变阳性NSCLC患者的临床治疗格局。
在EGFR-TKI药物遍地开花的同时,EGFR突变筛查的技术创新也从未止步,国内外权威指南均强调EGFR-TKI药物使用之前或耐药后应进行EGFR基因突变或T790M突变检测。与此同时,随着ctDNA检测技术的发展,使血液检测成为可能,国内外权威指南也提出在组织检测样本难以获取的情况下,可通过采集外周血ctDNA进行检测。在近期发表的文章和各类肺癌大会上,血液检测也成为精准医疗的讨论焦点,临床专家对各类血液检测平台的技术评价和疗效预测能力的评估研究也陆续发表,Super-ARMS等创新技术崭露头角,在血液ctDNA筛查EGFR T790M阳性患者使用奥希替尼的客观反应率达64%。EGFR基因突变检测技术的发展、从组织检测到血液检测的拓展应用,成为EGFR-TKI药物临床应用的有力支撑,开创EGFR基因突变阳性NSCLC精准诊疗新未来。
【柳暗花明又一村:ALK/ROS1-TKI,惊喜不断】
ALK融合基因和ROS1融合基因是非小细胞肺癌中多见的基因变异类型,在NSCLC中的发生率分别为3-11%和2-4%,多发生于年轻、非吸烟的腺癌患者。
克唑替尼具有ALK、c-MET、ROS1三个靶点,已被FDA批准用于ALK和ROS1阳性NSCLC患者的一线治疗。PROFILE 系列临床研究证实克唑替尼一线治疗ALK和ROS1融合NSCLC效果显著。对于ALK融合NSCLC患者,克唑替尼治疗的客观应答率为60%-74%,中位PFS为8-10个月,且疾病进展后继续使用克唑替尼仍可获益,mOS明显延长;对于ROS1融合NSCLC患者,克唑替尼治疗的客观应答率为72%,中位PFS为19.2个月。此外,在一项面对东亚患者(包含中国)的II期临床研究也表现出优异的疾病控制率(DCR)及PFS,基于该研究,日本厚生劳动省批准了全球首个ROS1伴随诊断试剂(艾德生物ROS1基因融合检测试剂盒)为克唑替尼临床用药的伴随诊断试剂,并批准克唑替尼用于ROS1阳性NSCLC患者。
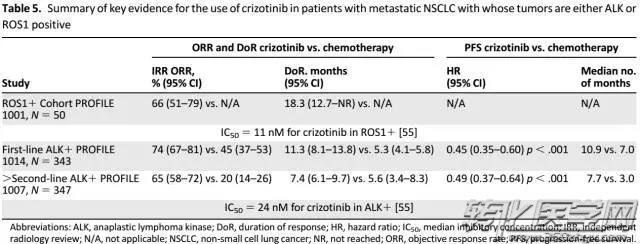
Kazandjian D, et al., Oncologist. 2016 Aug;21(8):974-80.
克唑替尼在ALK融合和ROS1融合NSCLC一线治疗的成功和上市,明显延长了ALK融合和ROS1融合NSCLC患者的mPFS,但是继发耐药也不可避免。以ALK融合的耐药突变为例,为了克服这些耐药突变,新的ALK抑制剂也已出现,包括ceritinib、alectinib、brigatinib、lorlatinib等。最初,这些TKI都是作为克服crizotinib耐药而被评价并表现出显著治疗应答和较好的mPFS,且对脑转移和脑膜转移患者也有治疗应答。
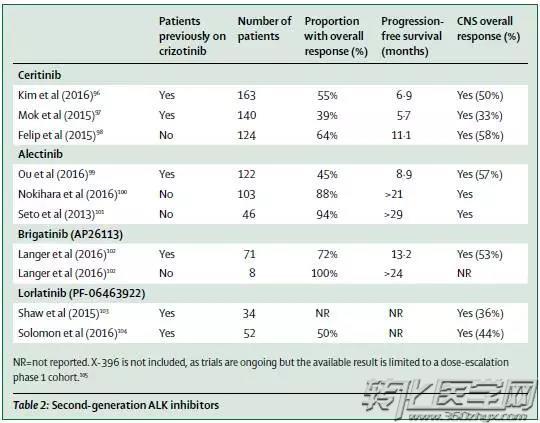
与此同时,在二代ALK-TKI与crizotinib进行一线治疗对比的临床研究中,Alectinib、Lorlatinib等甚至表现出更优异的应答率和更长的PFS。其中Lorlatinib对于ROS1阳性的患者也表现出不俗的成绩,可以说,一代又一代的ALK-TKI,惊喜不断。
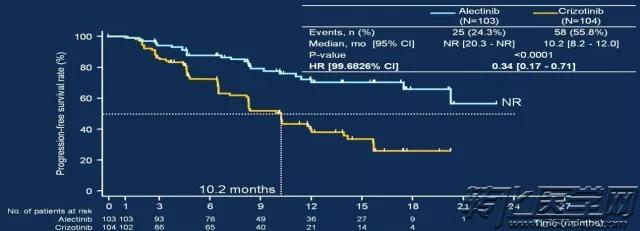
Hiroshi Nokihara. Abs 9008 ASCO 2016.
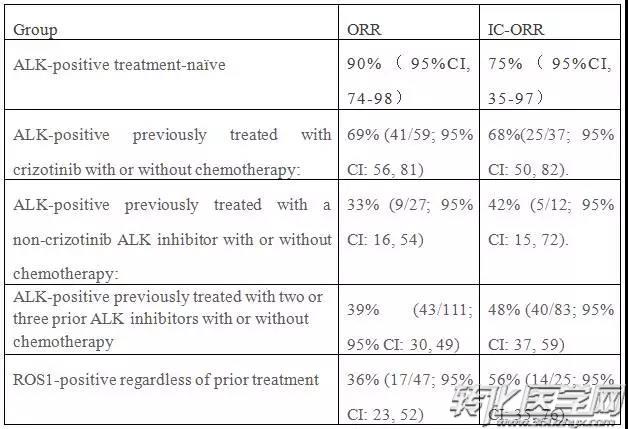
ALK、ROS1融合TKI药物的临床研究为ALK融合和ROS1融合NSCLC患者带来显著的临床获益。同时,也推动了融合基因检测技术的发展,以ROS1检测为例,从美国的PROFILE 1001研究使用传统的FISH检测到亚太的OO12-01研究使用更简单快捷、判读客观的RT-PCR检测,为多元化临床诊疗体系的建立提供了更丰富的临床证据。
与此同时,ALK、ROS1融合药物的上市,使NSCLC临床诊疗从EGFR基因单靶点诊疗跨越到EGFR、ALK、ROS1三靶点诊疗,推动了联合检测技术的发展。目前,基于简单快捷、高灵敏、高特异、高普及的qPCR平台,已有EGFR/ALK/ROS1联合检测基因获得药监局批准上市,实现了三基因的快速联检,极大地提高了诊疗效率。
【千树万树梨花开:罕见的基因,更多的选择】
针对EGFR、ALK、ROS1的TKI药物已是硕果满园,然而,对于肺癌靶向治疗基因和药物的探索远不止于此,研究者们探寻出更多新的驱动基因突变,将患者区分成不同的分子亚型并给予相应靶向治疗。
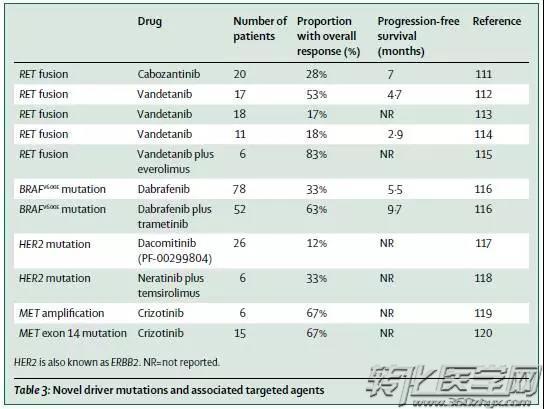
Hirsch FR et al. Lancet. 2016 Sep 3;388(10048):1012-24.
目前针对RET融合、BRAF突变、HER-2突变、MET扩增等各类突变类型的靶向治疗临床研究正如火如荼地展开,为无EGFR突变、ALK融合及ROS1融合的NSCLC患者带来曙光。以BRAF突变为例,2017年6月,FDA批准Tafinlar(dabrafenib)和Mekinist(trametinib)联合疗法,用于治疗肿瘤携带BRAF V600E突变的非小细胞肺癌(NSCLC)患者。而这正是基于一项名为BRF113928的II期临床试验中的优秀结果。该临床试验共招募了93名携带BRAF V600E突变的晚期NSCLC患者,其中36名未曾接受过治疗的患者每天使用150mg Tafinlar两次、使用2mg Mekinist一次,总体缓解率(ORR)达到61%,中位缓解持续时间无法估计;另外57名曾接受过化疗的患者使用同样剂量的药物,ORR达到63%,中位缓解持续时间为12.6个月。
随着对肺癌驱动基因不断深入的研究和探寻,越来越多的靶向药物不断涌现,令人振奋的同时也提出了挑战:如何在众多靶向药物中选择最合适的治疗方案?
精准医学时代,基因检测已成为肺癌诊治的第一步,无论是初始治疗或是耐药决策都应检测先行。快速、全面了解患者的靶向基因状态,才能真正让患者从治疗中获益!
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发